Formulación y nomenclatura de compuestos inorgánicos IUPAC 2005: ¿óxidos de halógenos o halogenuros de oxígeno?
Escrito por Quimitube el 11 marzo
Aunque parece que está costando bastante desterrar las normas anteriores e implantar las nuevas, la última actualización de la IUPAC para la nomenclatura y formulación de compuestos inorgánicos data del año 2005. En mi opinión está resultando costoso el arraigo (¡se publicaron hace ya 9 años!) por tres motivos. El primero es que, en general, a los miembros del profesorado nos cuesta hacer cambios; tenemos una línea trazada, que hemos seguido durante años, y es complicado salir de ese trazo. El segundo, que se necesita seguir conociendo las fórmulas y nombres previos a 2005 porque toda la documentación y artículos generados antes o próximos a esta fecha deben seguir comprendiéndose y utilizándose, y obviamente están escritos con la nomenclatura antigua. Y el tercero y último es que algunos de los nombres propuestos por la nueva normativa parecen ir en contra de nuestro instinto químico primario. O al menos, eso es lo que a mí me parece: cuando yo veo un compuesto formado por oxígeno y cualquier otro elemento, mi primera impresión es pensar en un óxido de algo. Y así era hasta antes de 2005, en todos los casos, óxidos deloquesea (tanto metal como no metal). Sin embargo, debemos prestar atención a esto porque se ha producido un cambio sustancial.
En base a las normas vigentes, cuando el oxígeno se combina con un halógeno se considera que el halógeno es el más electronegativo de los dos. Y el átomo más electronegativo, en las combinaciones binarias, debe colocarse siempre a la derecha y es a su raíz a la que se le coloca la terminación –uro. De este modo, cuando combinamos oxígeno y halógenos ya no se nombran como «óxido de halógeno(número de oxidación)», sino como «dihalogenuro de (prefijo)oxígeno», utilizando la nomenclatura de composición con prefijos multiplicadores. Veamos los distintos compuestos, con su fórmula y nombre anterior a 2005 y el actual:
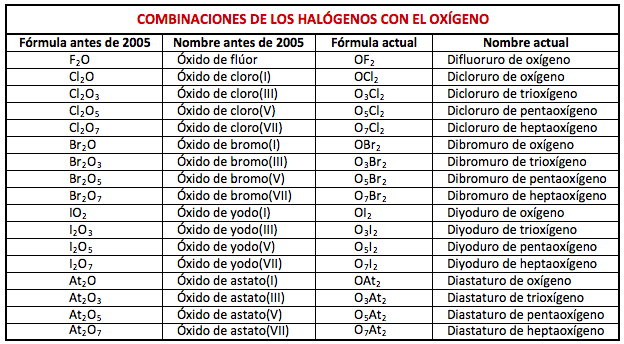
¿Es esto realmente así? Es decir, ¿son todos los halógenos más electronegativos que el oxígeno y deben, por tanto, escribirse a la derecha en la fórmula? Lo cierto es que no; estas son electronegatividades correspondientes, de mayor a menor:
Flúor: 3,98
Oxígeno: 3,44
Cloro: 3,16
Bromo: 2,96
Yodo: 2,66
Astato: 2,20
Como vemos, únicamente el flúor es más electronegativo. El cloro, el bromo, el yodo y el astato son menos electronegativos que el oxígeno.
Sin embargo, imagino que para que haya una coherencia en la nomenclatura y formulación de todos los compuestos formados por oxígeno y halógenos (de lo contrario podría ser un lío aún mayor), la IUPAC estableció un orden de electronegatividad de cara a la formulación que es en verdad distinto del real. Así, el orden que se debe seguir ahora es el siguiente:
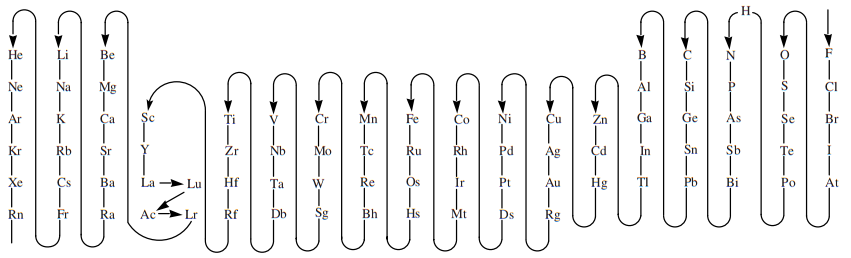
Este esquema nos indica que el átomo que aparece antes (desde donde empieza la flecha, en el flúor) se considera más electronegativo y, por tanto, debe ir escrito a la derecha en cualquier combinación binaria. Como vemos, todos los halógenos aparecen antes del oxígeno. A partir del azufre, que aparece inmediatamente después del oxígeno, ya vuelven a considerarse óxidos, escribiéndose el oxígeno a la derecha y el otro elemento a la izquierda, como por ejemplo el trióxido de azufre, SO3.





Perfecto. Yo soy profesor de F y Q y lo veo una completa barbaridad. Habría sido mucho más sencillo y práctico seguir como antes y, como mucho, introducir la excepción del Flúor y ya está. Lo de colar el Br y el I por delante del O en electronegatividad es lo dicho, una barbaridad.
José Antonio Montiel, 11 Años Antes
A mí tampoco me gusta, creo que va en contra de la lógica… Es mucho más fácil recordar, efectivamente, que únicamente el flúor es más electronegativo que el oxígeno y nada más, porque además es lo cierto. Gracias por tu comentario José Antonio. Un saludo.
QuimiTube, 11 Años Antes
hola! Buenos Días, tardes o noches, tengo cierta duda al respecto de lo publicado, si cambia la posición del oxigeno (positiv) a la derecha y el halogeno (negativo) a la izquierda
¿solo se podrian formar un compuesto de cada halogeno ya que esta en posición del negativo y posee solo una valencia negativa? o ¿ hay alguna posibilidad que estando en su lado negativo forme compuestos con sus valencias positivas?. saludos gracias por sus respuestas
Maryori, 11 Años Antes
¡Hola! Eso es lo «incongruente» a mi entender, de esta nomenclatura. Los halógenos siguen usando sus estados de oxidación positivos, por lo que como ves en las tablas, de cloro, bromo, yodo… sigue habiendo cuatro combinaciones posibles con el oxígeno, con sus números de oxidación positivos y el oxígeno con estado de oxidación -2.
QuimiTube, 11 Años Antes
Qué pasa cuando se combina el oxigeno con el fluor, ambos tienen nº de oxidación negativos de manera que según la sistemática de la formulación no quedaría un átomo neutro a pesar de que el OF2 si lo sea. Cómo se explica eso a los alumnos?
usue, 8 Años Antes
¡Hola! En las normas para determinar el número de oxidación se establece que, cuando el oxígeno se combina con el flúor, su número de oxidación es +2, por ser menos electronegativo. Aquí puedes verlo:
http://www.quimitube.com/teoria-redox/normas-determinacion-numero-oxidacion
Un saludo.
QuimiTube, 8 Años Antes