¡Marchando una de espectros! Espectros de emisión y absorción de los elementos químicos
Escrito por Quimitube el 28 noviembre
De vez en cuando, navegando por internet, uno encuentra algunas joyas que no se puede resistir a compartir. La joya con la que he dado hoy es de Educa Madrid (no es la primera vez que encuentro aquí recursos sumamente interesantes, por lo que compartiré con frecuecia) y es una herramienta flash para visualizar los espectros de manejo sencillo, tanto de emisión como de absorción, de los elementos químicos que van desde el hidrógeno, con Z=1, hasta el californio, con Z=98.
Herramienta para la visualización de los espectros de emisión y de absorción
Como he dicho, se puede elegir entre el espectro de emisión y el espectro de absorción para cada elementos registrado en la base de datos, lo que permite ilustrar fácilmente el hecho de que el espectro de emisión y el espectro de absorción de un mismo elemento son complementarios. Por ejemplo, si consideramos el caso del fósforo, sus espectros son:
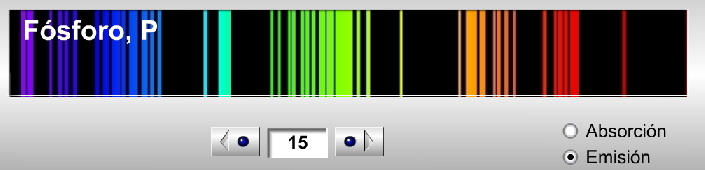
Espectro de emisión del fósforo
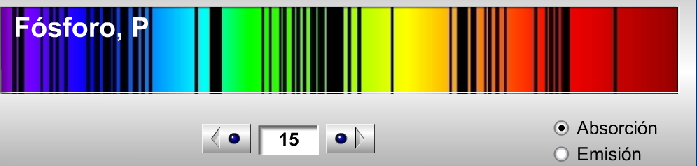
Espectro de absorción del fósforo
El motivo por el cual ambos espectros son complementarios es que las transiciones electrónicas que dan lugar a ambos espectros son las mismas. Cuando nosotros hacemos incidir radiación electromagnética sobre una muestra de átomos en estado gaseoso y fundamental (en este caso luz visible, como vemos en los espectros registrados), provocaremos la excitación de los electrones, esto es, se producirán transiciones electrónicas en las que los electrones pasan de un nivel inferior a un nivel superior. Los átomos pasarán de estar en un estado fundamental a un estado excitado. En este proceso los átomos absorben energía de unas longitudes de onda determinadas para cada elemento (de ahí que el espectro, tanto de emisión como de absorción de un elemento, se su huella dactilar, porque las transiciones electrónicas de cada átomo son distintas y únicas). Cuando registramos la luz que no ha sido absorbida por los átomos, lo que obtenemos es el espectro de absorción.
Si después dejamos que estos átomos excitados se relajen emitiendo la energía que previamente absorbieron y nuevamente hacemos un registro de esta radiación, entonces tendremos el espectro de emisión, formado por líneas discretas. Es lógico, por tanto, que sean complementarios: la radiación que absorbieron en un principio (y que no estará por tanto contemplada en el espectro de absorción) es la misma (misma longitud de onda) que emitirán después para dar el espectro de emisión.
Os recomiendo jugar con la herramienta, mirar diferentes espectros y, en especial, comprobar cómo se van complicando a medida que crece el número de electrones al aumentar también las posibles transiciones electrónicas (aunque esto no se cumple estrictamente, mirad, si no, el galio, Z=31, qué espectro de emisión tiene tan sencillo). A modo ilustrativo os dejo una secuencia de 3 espectros de emisión: el hidrógeno (Z=1), el carbono (Z=6) y el cloro (Z=17).
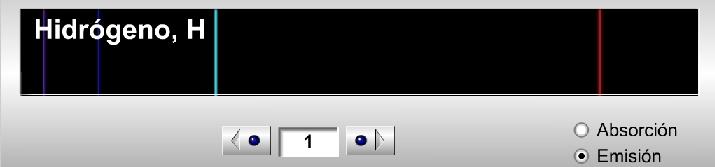
Espectro de emisión del hidrógeno

Espectro de emisión del carbono
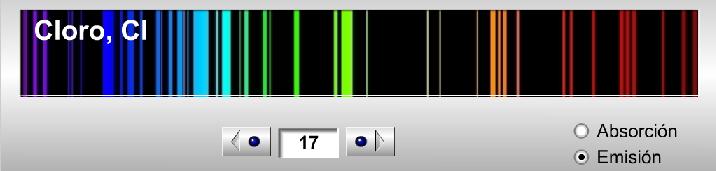
Espectro de emisión del cloro








felicidades por la fantastica web y blog que teneis, me encanta y yo que me dedico también a la enseñanza recomiendo mucho esta página, de nuevo mi enhorabuena!!! sois geniales
clasesquimicaengranada@webnode.es
antonio castellón, 12 Años Antes
que genial
g, 11 Años Antes
Gracias Antonio, viniendo de una persona que también se dedica a dar clases es muy gratificante este comentario. Un saludo grande 🙂
QuimiTube, 12 Años Antes
no la he revisado bien pero me gusta lo que he visto puede no valer mucho pero los felicito soy profesor de química
JUAN PASAGUAY, 11 Años Antes
Muchas gracias Juan, viniendo este comentario de un colega cobra un gran valor. Un saludo grande.
QuimiTube, 11 Años Antes
quee buenas tareas es bueno estdiar
maria de los angeles, 11 Años Antes
¡Gracias!
QuimiTube, 11 Años Antes
Excelente, muchas gracias. Como puedo bajar el programa que contiene esta base de datos a mi Pc??
Pablo Ulloa, 11 Años Antes
¡Hola Pablo! Esto no lo sé, creo que tendrías que ponerte en contacto con los autores para preguntarles si lo permiten y si es posible técnicamente. Un saludo.
QuimiTube, 11 Años Antes
[…] Según los átomos de los que esté hecho un material, ante determinadas longitudes de onda, se excitará, pasará de un estado fundamental a un estado excitado, o de un estado excitado a otro más excitado: es decir, sus electrones saltarán de un nivel de energía a otro. En el caso del TiO2, cuando recibe luz de longitud de onda menor o igual a 400 nm se produce una reacción de oxido-reducción, y el titanio pasa de estar 4+ al estado 3+ (ha ganado un electrón). De hecho leí acerca del TiO2 que se piensa en usarlo para almacenar energía renovable, el artículo científico en el que se basa desciende a más detalle acerca de los estados por los que pasa el TiO2. Para aprender (y jugar) con los espectros de los átomos, está muy bien esta página. […]
PHdC 76: | Hablando de Ciencia | Artículos, 10 Años Antes
No encuentro los espectros de emision de el carbono y en esta pagina no aparecen
DX
Roberto Carlos, 9 Años Antes
¡Hola! Lo siento, no tenemos una base de datos de espectros pero en el enlace que te proporciamos sí deberías encontrarlo.
QuimiTube, 9 Años Antes