¿El enlace del cloruro de berilio es covalente o iónico?
Escrito por Quimitube el 16 enero
Habitualmente, cuando en la asignatura de química de 2º de bachillerato se explica la hibridación, se toma el cloruro de berilio como ejemplo de molécula lineal con hibridación sp. Así ocurre en la mayoría de textos de este nivel y en otros de química general. De hecho, es este mismo ejemplo el que elegimos en Quimitube para dicha explicación, tal y como podéis ver en el vídeo explicativo correspondiente a la hibridación sp sin enlaces múltiples. La geometría de la molécula de BeCl2 es lineal, lo cual predecimos a partir de la Teoría de repulsión de los pares electrónicos de la capa de valencia (dos pares electrónicos en torno al átomo central, el berilio):
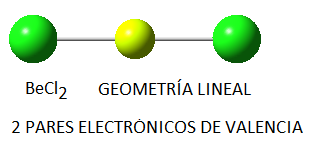
Mientras que, partiendo de la hibridación sp, podemos considerar que los híbridos sp del berilio se enlazan con un orbital 3p del cloro (el único orbital del cloro con un electrón desapareado en su capa de valencia).
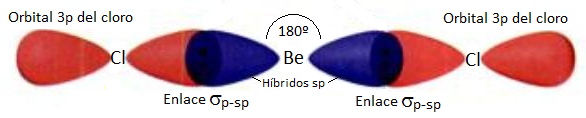
Sin embargo, desde el momento en que hablamos de una molécula de BeCl2, y aplicamos para la explicación de su geometría la teoría de la hibridación de orbitales, estamos considerando que el enlace entre el berilio y el cloro es un enlace covalente. Pero el berilio es un metal y el cloro es un no metal, ¿no tendrían que formar un enlace iónico y, por tanto, una red cristalina? ¿Por qué se considera este compuesto como un ejemplo típico de enlace covalente?
Bueno, en primer lugar debemos incidir en el hecho de que los enlaces covalentes e iónicos, tal y como se suelen estudiar, son en verdad casos extremos. Desde un compuesto como la molécula de flúor, F2, totalmente apolar, hasta un compuesto iónico como el fluoruro de cesio, CsF, habrá muchos compuestos intermedios. A partir del F2 ( y otras moléculas homonucleares, como Cl2, por ejemplo), tendremos moléculas cada vez más polares, la nube de carga se irá desplazando un poquito más sobre uno de los átomos del enlace… y nos iremos aproximando al enlace iónico, en el que hay una transferencia real de la carga para formar cationes y aniones. Hablamos, entonces, del carácter iónico de un enlace covalente, en función de cómo de desplazada se halle la nube electrónica del enlace hacia uno de los átomos. Es un valor que se puede determinar en tanto por ciento.
El carácter iónico de un enlace se puede calcular de dos formas distintas: a partir de la fórmula de Pauling, con la electronegatividad, y utilizando los datos de momento dipolar y distancia de enlace.
Ya hemos visto en los ejercicios de enlace químico las dos formas de calcular el carácter iónico de un enlace. Esta es la fórmula de Pauling con la diferencia de electronegatividad y esta otra por polaridad y distancia de enlace.
Para el caso que nos ocupa, el del cloruro de berilio, vamos a considerar la primera forma. Según Pauling, el carácter iónico de un enlace es:
% carácter iónico = 100·[1-e^((-1/4)·(ΔEN)^2)]
Donde ΔEN es la diferencia de electronegatividad entre los átomos que forman el enlace.
Si despejamos en la fórmula, obtenemos que todo enlace cuya diferencia de electronegatividad entre los átomos que lo forman sea superior a 1,7, tendrá más de un 50% de carácter iónico, mientras que el que tenga una diferencia de electronegatividad inferior a 1,7, tendrá menos de un 50% de carácter iónico.
¿Y qué ocurre con el cloruro de berilio? Que la diferencia de electronegatividad entre sus átomos es de 1,5 (electronegatividad del berilio: 1,5 ; electronegatividad del cloro: 3,0). Si utilizamos la fórmula de Pauling para calcular su porcentaje de carácter iónico:
% carácter iónico = 100·[1-e^((-1/4)·(1,5)^2)] = 43%
Como vemos, un carácter iónico inferior al 50%, lo que implica mayor carácter covalente. Y, de hecho, se sabe experimentalmente que el cloruro de berilio forma moléculas y no redes cristalinas; a partir de 750ºC las moléculas son de BeCl2 (tal y como las estudiamos en hibridación), a temperaturas algo más bajas, forma dímeros, mientras que en estado sólido, el cloruro de berilio forma agregados, en los que los berilios actúan como ácidos de Lewis aceptando un par electrónico de los átomos de cloro, para formar largas cadenas con unidades tetraédricas de BeCl4:
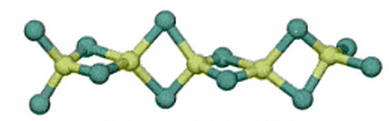
Por este motivo, es decir, que el berilio tiene una electronegatividad de 1,5, los compuestos de berilio tienen una covalencia pronunciada, mucho más que sus homólogos metales alcalinotérreos, como el magnesio o el calcio, que son más electropositivos que él.





Información Bitacoras.com…
Valora en Bitacoras.com: Habitualmente, cuando en la asignatura de química de 2º de bachillerato se explica la hibridación, se toma el cloruro de berilio como ejemplo de molécula lineal con hibridación sp. Así ocurre en la mayoría de textos de este n…..
Bitacoras.com, 11 Años Antes
Una perfecta explicación. Muchisimas gracias
José Antonio, 11 Años Antes
De nada 🙂 Gracias a ti por darme la idea para una nueva entrada de blog.
QuimiTube, 11 Años Antes
Nesesito saber una respuesta?
Mencionar las propiedades generales para un compuesto ionico y un compuesto molecular?
Nitza Deliz, 11 Años Antes
¡Hola! Te recomiendo que veas los vídeos teóricos al respecto.
Sobre las propiedades de los compuestos iónicos: http://www.quimitube.com/videos/propiedades-de-los-compuestos-ionicos/
Sobre las propiedades de los compuestos covalentes: http://www.quimitube.com/videos/propiedades-de-las-sustancias-covalentes-moleculares/
QuimiTube, 11 Años Antes
excelente explicación! tenía muchas dudas sobre este caso particular! despejadas gracias a ustedes!!!!
pilar, 10 Años Antes
Clarísima la explicación a algo que no viene en los libros
jose M, 7 Años Antes