El comportamiento ácido base de los aminoácidos
Escrito por Quimitube el 1 octubre
Un aminoácido, como su propio nombre indica, no es más es un compuesto químico que presenta un grupo amino, -NH2, y un grupo ácido carboxílico (o también grupo carboxilo o grupo carboxi), -COOH. Son 20 los aminoácidos que forman las proteínas, y sin los que, por tanto, no podríamos vivir; todos estos aminoácidos tan importantes son lo que llamamos α-aminoácidos, lo cual significa que el grupo amino y el grupo carboxilo están unidos a un mismo átomo de carbono. Así, de forma general podemos escribir que un α-aminoácido es:
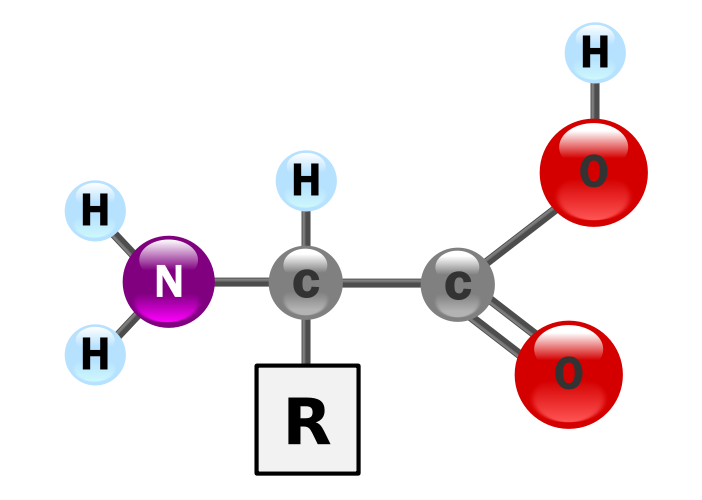
Podemos ver en la estructura de un α-aminoácido genérico que tanto el grupo -NH2 como el grupo -COOH están unidos a un mismo átomo de carbono. Este carbono recibe el nombre de carbono alfa y está unido a su vez a un grupo R o cadena lateral, distinto para cada aminoácido.
Como hemos visto en algunos vídeos del tema de ácido base con compuestos similares (por ejemplo el amoníaco, NH3), podemos decir que el grupo amino de un aminoácido presenta un comportamiento básico, ya que se puede protonar para dar -NH3+, o que un grupo carboxilo, -COOH, presenta un comportamiento ácido, ya que se puede desprotonar para dar -COO–. Es decir, de forma muy general, podemos escribir, para cada uno de los grupos por separado en disolución acuosa:
Comportamiento básico del grupo amino de un aminoácido: R-NH2 + H2O → R-NH3+ + OH–
Comportamiento ácido del grupo carboxílico de un aminoácido: R-COOH +H2O → R-COO– + H3O+
En realidad, es más frecuente encontrar los aminoácidos en disolución acuosa (lo que vamos a explicar con mayor profundidad en esta entrada) con el grupo amino protonado y con el grupo carboxílico desprotonado. Es decir, la estructura genérica de un alfa-aminoácido es distinta a la que hemos indicado previamente y sería más exacto escribir:
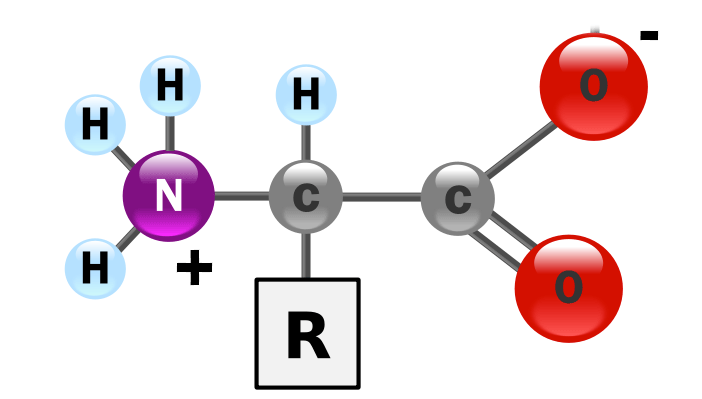
Estructura genérica de un alfa-aminoácido en forma zwiteriónica: el grupo carboxílico se halla desprotonado y el grupo amino protonado, aunque la carga neta sigue siendo cero. La forma de protonación de los aminoácidos en solución acuosa depende del pH del medio.
Dicho esto, podríamos plantearnos lo siguiente: Si todos los aminoácidos que forman las proteínas tienen una estructura similar, con un grupo amino y un grupo carboxilo en posiciones adyacentes, ¿serán ácidos y bases idénticos? Es decir: ¿tendrán el mismo comportamiento ácido-base todos ellos, la misma fortaleza? La respuesta es que no, y el motivo es el entorno de dichos grupos. Es decir, no solo los grupos con comportamiento ácido base en sí mismos, sino también los átomos que hay a su alrededor en la molécula (como la cadena lateral R), afectan a la tendencia de dichos grupos para ceder o captar electrones. Por este motivo, cada uno de los 20 aminoácidos que forman las proteínas en nuestro organismo tiene un comportamiento ácido-base distinto a pesar de poseer los mismos grupos, el grupo amino y el grupo carboxilo. Es más, su comportamiento puede llegar a ser muy distinto, no solo por estos dos grupos que indicábamos previamente, sino porque en las cadenas laterales, R, también puede haber grupos con características ácidas o básicas, como veremos. En general, podemos decir que se trata de sustancias anfóteras, que podrán comportarse como ácidos y como bases en función del pH del medio en el que se encuentren.
Veamos sus estructuras para poder observar con mayor detenimiento los grupos que forman sus cadenas laterales R:
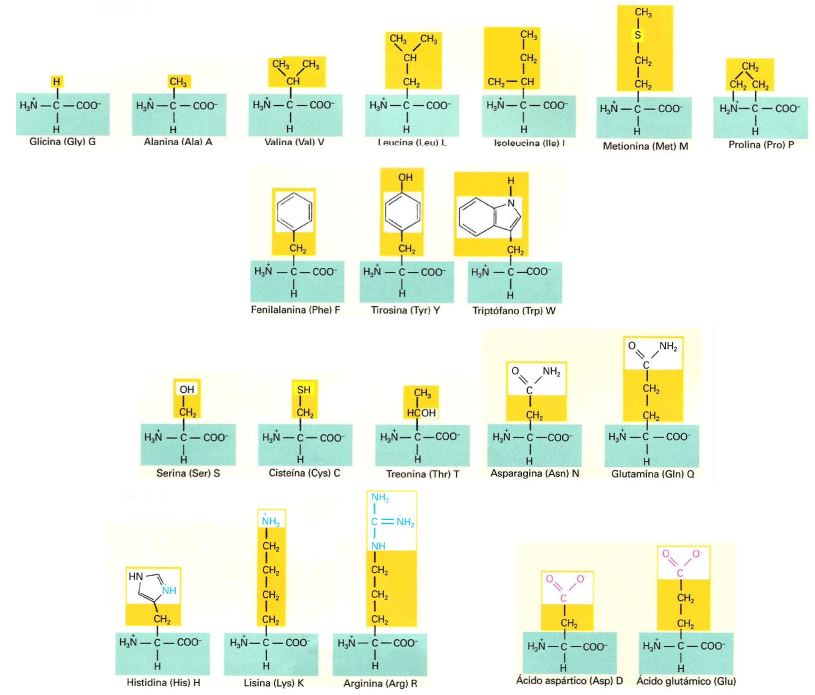
Cadenas laterales (en amarillo) de los 20 aminoácidos que forman las proteínas. Se puede observar que son muy variadas, desde la glicina, que presenta únicamente un átomo de hidrógeno, hasta otros mucho más complejos, como el triptófano o la arginina. Fuente: Universidad de Alcalá de Henares
Si consideramos los aminoácidos neutros, que no tienen grupos ionizables ni polares en la cadena lateral R, pueden hallarse en equilibrio, principalmente, entre tres formas distintas: como catión, como zwiterión o como anión. Así:
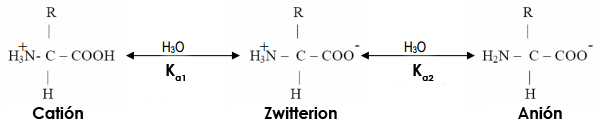
El estado de ionización de estos grupos depende del propio aminoácido y del pH del medio. Como vemos, los aminoácidos neutros (que no presentan ningún grupo ácido o básico adicional) pueden hallarse en forma de catión, cuando el grupo amino está protonado y el grupo carboxílico como -COOH, en forma zwiteriónica o de ion dipolar (ambos grupos ionizados, carga global cero) o en forma de anión, cuando el grupo amino está desprotonado y el grupo carboxílico también. Así, tenemos dos equilibrios químicos en el tránsito de unas formas a otras, cada uno de ellos regido por una constante de acidez, Ka1 (para la desprotonación de -COOH) y Ka2 (para la desprotonación de NH3+). Si en lugar de hablar de constantes hablamos de pKa, para la primera constante, el pKa1 suele tener un valor entre 2-3, que indica que el grupo -COOH es un ácido relativamente fuerte. Para la otra constante, sin embargo, pKa2, suele tener un valor entre 9-10, que indica que el grupo amino protonado, -NH3+, es un ácido un tanto mediocre. Podemos ver estos valores en la tabla siguiente tanto para los aminoácidos neutros (polares y apolares) como para los ácidos y básicos, que presentan otros grupos ionizables en su cadena lateral R (de la que se muestra también el valor de pKa).
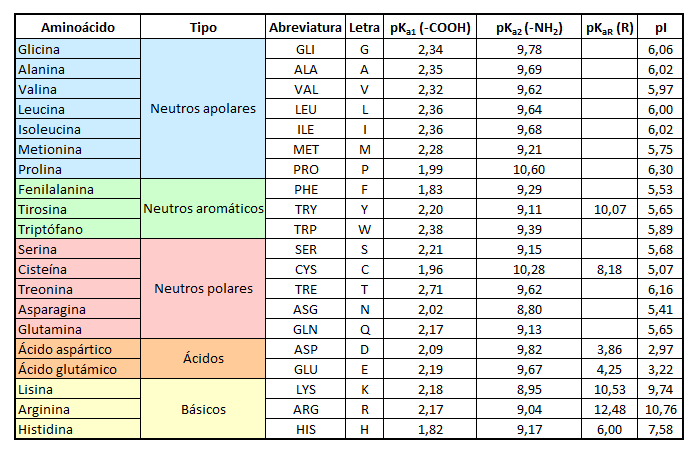
Valores de pKa para los distintos grupos ionizables de los 20 alfa-aminoácidos que forman las proteínas y punto isoeléctrico
En la tabla se observa que la última columna aparece con el nombre de «pI». Esto corresponde al llamado punto isoeléctrico de los aminoácidos. ¿Qué es el punto isoeléctrico? Pues es el valor de pH del medio al cual el aminoácido se halla con carga eléctrica global 0, aunque está protonado el grupo amino y desprotonado el grupo carboxílico. Es decir, es el pH al cual hallamos el aminoácido en forma zwiteriónica. En los aminoácidos neutros que presentan únicamente como grupos ionizables el -NH2 y el -COOH, para calcularlo basta hacer la media aritmética de los dos valores de pKa, es decir:
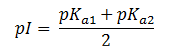
Siempre se cumple que:
A pH inferior al punto isoeléctrico, los aminoácidos están en forma catiónica.
A pH superior al punto isoeléctrico, los aminoácidos están en forma aniónica.
Asimismo, a los distintos equilibrios propuestos para un aminoácido, al tratarse de ácidos débiles y sus bases conjugadas correspondientes, se les puede aplicar la ecuación de Henderson-Hasselbalch, útil para calcular la concentración exacta de cada una de las especies, conocido este valor de pH y el pKa del equilibrio considerado. Recordemos que esta ecuación tiene la forma siguiente:
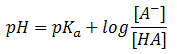
¿A qué tipo de disoluciones vimos en teoría que aplicábamos esta ecuación? La vimos para lasdisoluciones reguladoras o tampón. En efecto, una disolución de un aminoácido se comporta como una disolución tampón, es decir, los aminoácidos tienen capacidad tamponadora, y es máxima cuando nos hallamos en valores de pH próximos al pKa. En especial la histidina se comporta como un buen tampón a pH fisiológico debido a la presencia de un grupo lateral con pKa de 6,00, cercano al habitual.





[…] Un aminoácido, como su propio nombre indica, no es más es un compuesto químico que presenta un grupo amino, -NH2, y un grupo ácido carboxílico (o también grupo carboxilo o grupo carboxi), -COOH. Son 20 los aminoácidos que forman las proteínas, y sin los que, por tanto, no podríamos vivir; todos estos aminoácidos tan importantes son lo que llamamos α-aminoácidos, lo cual significa que el grupo amino y el grupo carboxilo están unidos a un mismo átomo de carbono. […]
Comportamiento ácido base de los amino&a..., 10 Años Antes
ademas de la quimica, el experimento tiene alguna relacion con la fisica?
mi hija debe presentar un experimento en clases pero el mismo debe tener relacion con quimica y fisica. este me sirve?
yulimar campos, 10 Años Antes
Hola Yulimar, lo cierto es que no se me ocurre cómo relacionarlo con la física de forma clara…
QuimiTube, 10 Años Antes
Información exacta, compacta y precisa. Gracias por reunir esta información, les mando un saludo desde México.
Israel Aguila Martinez, 9 Años Antes