¿Podemos predecir con cálculos si un gas será más denso que el aire?
Escrito por Quimitube el 26 mayo
El aire tiene una densidad a una temperatura de 0ºC (273,15 K) y 1 atmósfera de presión es de 1,29 g/L [1].
Sabemos que, cuando un gas es más denso que el aire, este se acumula en la parte inferior y que, por el contrario, si es menos denso se acumula en la parte superior. Este es, por ejemplo, el motivo de que en un incendio lo gente avance agachada o arrastrándose por el suelo: el monóxido de carbono, un gas altamente asfixiante (puedes leer nuestra entrada sobre la muerte dulce aquí) es menos denso que el aire y esto hace que en la parte inferior de la estancia su concentración sea inferior.
Ahora bien, cabe preguntarse, ¿cómo podemos saber si un gas va a ser más o menos denso que el aire? Dicho de otro modo: ¿podemos calcular de forma teórica la densidad de un gas? La respuesta es que sí. De forma aproximada, podemos utilizar la ley de los gases ideales y realizar algunos cálculos estequiométricos para calcular la densidad de un gas. A continuación vemos cómo podemos deducir la densidad del gas a partir de dicha expresión. Para ello, recordemos que el número de moles es igual a m/M, donde m es la masa presente y M la masa molecular del gas, y la densidad es m/V.
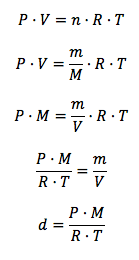
Deducción de la densidad de un gas a partir de la ley de los gases ideales
Es decir, la densidad se puede calcular conociendo la presión (P, en atm), la masa molecular del gas (M, g/mol), la constante de los gases ideales (R, atm·L/K·mol) y la temperatura (en K). Esta fórmula implica, por tanto, que a unas determinadas condiciones de presión y temperatura, la densidad de un gas depende únicamente de su masa molecular, siendo ambas magnitudes directamente proporcionales. De este modo, los gases con masas moleculares menores que la media ponderada del aire serán menos densos que éste, y los gases con masas moleculares mayores serán más densos.
Por ejemplo, calculemos el caso del monóxido de carbono, CO, en las mismas condiciones de presión y temperatura.
d = (1 atm · 28g/mol) / (0,082 (atm·L/K·mol)·273 K) = 1,25 g/L
Como vemos, aunque no es mucha la diferencia, es en efecto menos denso que el aire, cuya densidad es, como hemos indicado previamente, de 1,29 g/L en estas mismas condiciones.
Considerando un gas más pesado, que será por tanto más denso que el aire, como el hexafluoruro de azufre (SF6), y cuya masa molecular es de 146 g/mol, su densidad será muchísimo mayor:
d = (1 · 146) / (0,082 · 273) = 6,52 g/L [2]
Por tanto, basta con conocer M, la masa molecular de un gas, para calcular de forma aproximada su densidad a unas determinadas condiciones.
[1] Aire Wikipedia
[2] Comparación de las densidades calculadas y de las densidades reales para distintos gases
También te puede interesar:
Leyes de los gases (I): la ley de Boyle-Mariotte





Hace un año escribí sobre el número de Avogadro (puede encontrarse la entrada aquí. En esa entrada, elaboré una tabla que compara la densidad predicha de 17 gases con su densidad real. Se puede apreciar que este método es, de hecho, bastante preciso. Sólo se producen errores relativamente grandes (siempre menores del 10%, según comprobé) con algunos gases, siendo lo normal un error relativo entre el 0 y el 1%). La tabla en cuestión es ésta.
Un post muy didáctico. ¡Un saludo! 😀
Manolo, 9 Años Antes
Hola Manolo, ¡genial tu tabla con los datos! Muchas gracias por compartir la información. Te enlazo en la propia entrada. Un saludo grande.
QuimiTube, 9 Años Antes
Muchas gracias por el aporte!! Fue muy buena tu explicación podría decir mejor que en el libro del cual estoy estudiando jaja
Vicky, 8 Años Antes
que buena informacion la verdad me ha sido de ayuda, pero realmente quiero saber es como se puede sar un aerometro para calcular la densidad de gases o del aire, ya que casi no hay mucha informacion sobre este instrumento
santiago, 4 Años Antes
¡Hola Santiago! Lo lamento, yo tampoco dispongo de información sobre el uso de dicho equipo… has probado a buscarlo en inglés? Un saludo.
QuimiTube, 4 Años Antes