¿Cuántos compuestos hay formados únicamente por carbono y oxígeno? Los oxocarbonos
Escrito por Quimitube el 16 noviembre
Cuando uno piensa en compuestos formados únicamente por átomos de carbono y de oxígeno, lo más probable es que le vengan a la mente dos: el monóxido de carbono, CO, y el dióxido de carbono, CO2. Sin embargo, no son estos dos ejemplos los únicos compuestos formados únicamente por carbono y oxígeno, juntos dan lugar a una química rica y muy sorprendente. En esta entrada vamos a hacer un repaso por los distintos tipos de compuestos a que la combinación de estos elementos da lugar.
Monóxido de carbono y dióxido de carbono
Sin duda estos dos compuestos de carbono y oxígeno son los más importantes; no solo en cuanto a abundancia sino también por otras consideraciones. Por ejemplo, el CO es altamente tóxico y produce la llamada muerte dulce, mientras que el CO2 es un importante gas a nivel medioambiental por su implicación en el efecto invernadero.

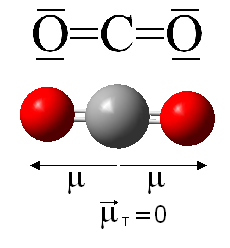
Se pueden decir muchas cosas de ambos compuestos y profundizaremos más adelante; en esta entrada vamos a centrarnos en otros compuesto de oxígeno y carbono menos frecuentes.
El monóxido de dicarbono, C2O
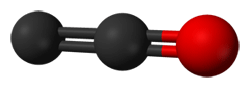
El monóxido de dicarbono es un compuesto de fórmula molecular C2O y extremadamente reactiva, que contiene dos átomos de carbono y un átomo de oxígeno unidos mediante enlace doble.
![]()
Se produce por la fotólisis del subóxido de carbono [1], una molécula aún más especial que veremos a continuación. A pesar de su inestabilidad, es suficientemente estable como para observar reacciones con óxidos de nitrógeno, como NO y NO2 [2].
El subóxido de carbono, C3O2 , y otros compuestos lineales
El subóxido de carbono y otros similares es probablemente el compuesto más raro de oxígeno y carbono, a pesar de que fue descubierto ya durante el siglo XIX por Benjamin Brodie mediante el paso de corriente eléctrica a través de monóxido de carbono. Es un compuesto totalmente lineal formado por cinco átomos, 3 carbonos centrales y unidos entre sí y, en los extremos, los dos oxígenos. Todos ellos se unen mediante enlace doble. También podemos denominarlo dióxido de tricarbono.
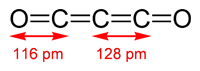
Aunque no aparecen dibujados en la estructura previa, cada átomo de carbono presenta dos pares electrónicos libres.
El hecho de que presente cuatro enlaces dobles seguidos hace que se comporte como un cumuleno, de los que hablaremos con más profundidad en una entrada posterior. En general podemos decir que pertenece a una serie de compuestos que podemos denominar oxocarbonos, y que responden a la fórmula O=Cn=O. El C3O2 se emplea en algunas síntesis de laboratorio (como en la síntesis de malonatos) aunque es un compuesto inestable, que espontáneamente polimeriza para dar lugar a un polímero amarillo, rojo o negro. Se llegó a postular que era esto lo que daba el color rojizo a Marte, pero fue desmentido por el Programa Viking de la NASA de estudio del planeta rojo. A temperatura ambiente es un gas, ya que su punto de ebullición es de 6,8ºC.
Existen otros compuestos similares a este subóxido de carbono, como el C4O2, o el C5O2, también lineales, cuyas fórmulas son prácticamente iguales al anterior solo que adicionando un carbono más en el núcleo central:
![]()
![]()
Anhídrido oxálico o trióxido de dicarbono, C2O3
El anhídrido oxálico es un compuesto con la siguiente fórmula molecular:
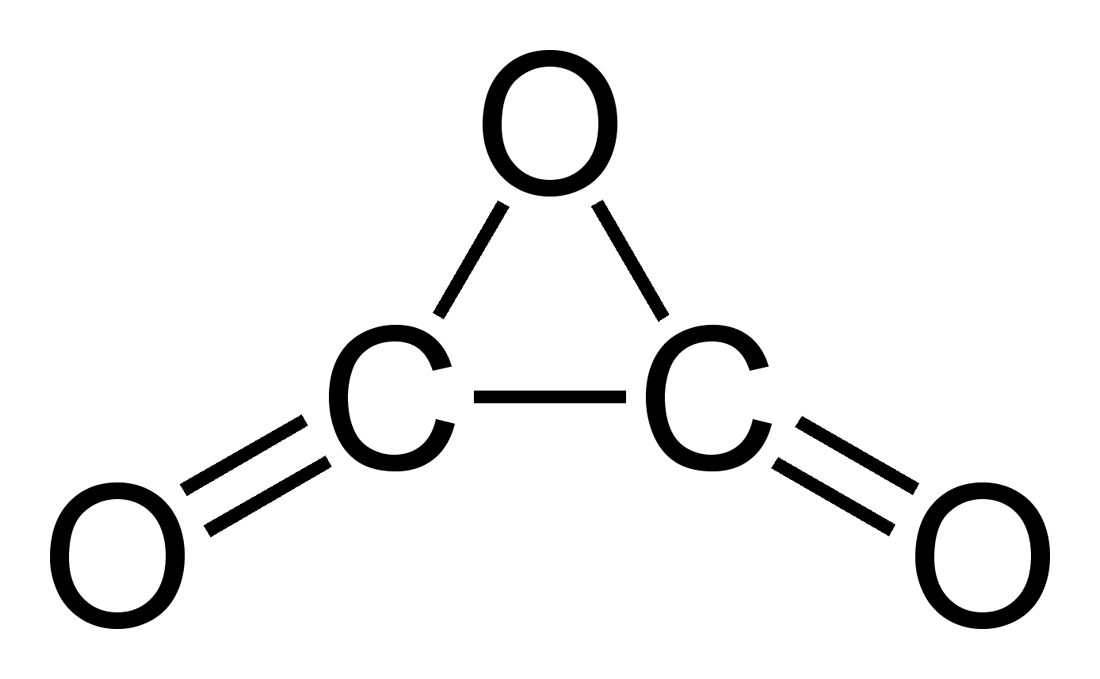
La presencia de un ciclo de 3 miembros hace que sea realmente inestable, por lo que únicamente se ha logrado observar, aparentemente, en una ocasión, en el año 2009. Sí que se logró sintetizar en 1998 un pariente muy cercano, el dímero C4O6. Aún así, como decimos, es muy inestable y raro y más bien parece ser el intermedio de reacción de la descomposición de ciertos oxalatos y de algunas otras reacciones específicas.
Otros oxocarbonos reales y teóricos
Aunque lo más habitual es que cuando se habla de oxocarbonos se haga referencia principalmente a los compuestos que se han comentado hasta el momento, especialmente el C2O y el C3O2, lo cierto es que se han descubierto, en condiciones especiales, otros compuestos de oxígeno y carbono realmente sorprendentes, como el trianhídrido metílico, una estructura tal que así:
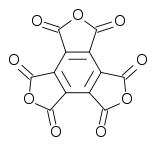
A diferencia de otros oxocarbonos, el trianhídrido metílico tiene carácter aromático, lo que hace que sea más estable. A temperatura ambiente es un óxido blanco.
Además de este, el grupo de los oxocarbonos es amplio y no para de crecer con nuevos individuos. De hecho, echar un vistazo a esta entrada de wikipedia hace que uno se haga una idea de la gran cantidad de combinaciones a que pueden dar lugar estos dos elementos tan importantes. Así, se pueden proponer oxocarbonos con fórmulas como CO4, CO5, CO6, C3O3, C3O6, C5O2, C6O6, C8O8, C12O12…
También se han estudiado a nivel teórico otros compuestos que podrían existir, pero que, sin embargo, todavía no han sido descubiertos. Es el caso de los ciclos formados por carbono y oxígeno con grupos oxo unidos a los mismos, como:
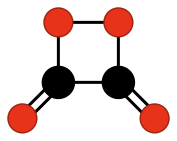

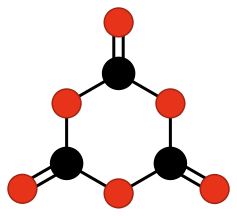
Mientras que otros compuestos más complejos de carbono y oxígeno sí que son estables o metaestables y han podido ser sintetizados desde 1960, como:
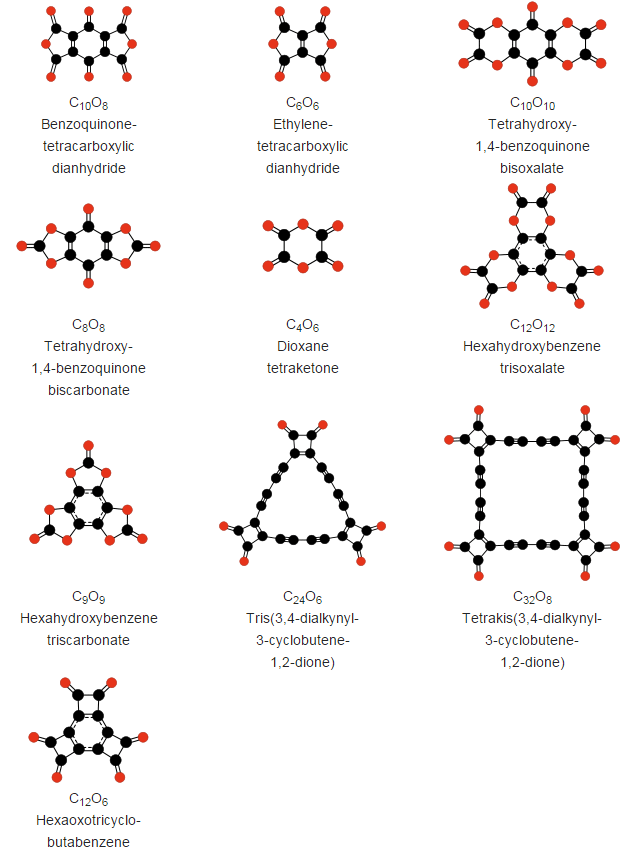
Como podéis ver, estructuras impresionantes que, si bien ahora no parecen más que una mera curiosidad para profundizar en distintas estructuras químicas, quién sabe qué propiedades podrían exhibir en el futuro.
Referencias y más información:
[1] Bayes, K. (1961). «Photolysis of Carbon Suboxide». Journal of the American Chemical Society 83 (17): 3712–3713. doi:10.1021/ja01478a033.
[2] Thweatt, W. D.; Erickson, M. A.; Hershberger, J. F. (2004). «Kinetics of the CCO + NO and CCO + NO2 reactions». Journal of Physical Chemistry A 108 (1): 74–79. doi:10.1021/jp0304125.





Hola.
Yo les puse a mis alumnos hace unos días que me dibujaran todas las estructuras posibles con Carbono e Hidrógeno (sin contar isómeros geométricos y ópticos, que están en cuarto, jejeje, y cosas como los clústers o fullerenos/grafenos/grafinos/…).
De hecho puse la pregunta en chemstackexchange donde tengo algunas otras preguntas interesantes:
http://chemistry.stackexchange.com/questions/19475/hydrocarbons-with-only-4-carbon-atoms
Un cordial saludo
Amarashiki, 10 Años Antes
¡Hola! Es verdad, muy interesante. Parece increíble la cantidad de estructuras planteables solo con 4 átomos de carbono y el hidrógeno necesario, he visto la respuesta a esa pregunta que planteaste en stackexchang y sorprende muchísimo. ¡Gracias por comentar!
QuimiTube, 10 Años Antes
De nada. Tu post sobre los oxocarbonos (¿»sexocarbonos»?Son sexies, LoL) era absolutamente irresistible (como algunos de tus vídeos), y más sabiendo que hace unos días había mandado esa actividad en cuarto de la E.S.O. y que yo mismo usé teoría de (multi)grafos química para facilitarme la resolución sistemática del problema. No había pensado en poner algo como los oxocarbonos…Pero puede ser un bonito ejercicio para otra ocasión…
Ha sido una asombrosa coincidencia que trataras un problema similar al que yo solucioné hace unos días (coincidencia dos). Tanto o más, que al resolver el problema, yo mismo me diera cuenta que el año próximo tendré exactamente un número de años igual al número de estructuras que resuelven el problema de los hidrocarburos sin contar isomería o formas resonantes (coincidencia uno).
Amarashiki, 10 Años Antes
Mira este post http://chemistry.stackexchange.com/questions/19545/resonant-structures-and-existence-of-simple-compounds-with-4-carbon-atoms-and
Un post de Química para mi 37 cumpleaños estaría bien…
Fíjate que si ampliamos a 5 o más átomos de carbono el número de posibles estructuras crece muy rápidamente…
Amarashiki, 10 Años Antes
Bueno me sorprende la capacidad del hombre que en estos tiempos no lo usan para nada bueno pero es muy impresionante
Reinitapro, 4 Años Antes