La muerte dulce: asfixia por monóxido de carbono, CO
Escrito por Quimitube el 23 julio
El verano pasado asistí a un curso de verano en la sede de la UNED de Baleares, titulado «Ciencia en el crimen«, que se está volviendo a realizar durante estos días. Uno de los ponentes, además de un gran orador, era médico forense de los juzgados, y nos refirió que un par de días antes de la charla había tenido que practicar la autopsia al cuerpo de una chica. Le llamó la atención, según nos dijo, que la joven parecía estar simplemente dormida (piel rosada, expresión tranquila en el rostro…)
La chica era una turista rusa que estaba en Mallorca de vacaciones, y había aparecido muerta en la habitación de su hotel. Lo primero que pensó el forense fue: «Quizá sea un caso de drogas». No obstante, la apariencia del cuerpo no era consistente con una sobredosis; únicamente cuadraba con una intoxicación por monóxido de carbono. ¿Cómo era posible? ¿Qué lógica tenía que una persona pudiese morir asfixiada por monóxido de carbono en la habitación de un hotel, en pleno verano, cuando no se encienden ni calderas ni estufas? Parecía imposible…

Pero, en efecto, más tarde se descubrió que se había estado formando (imagino que durante años) una bolsa de monóxido de carbono en el falso techo por mala combustión de las calderas y que, por mala fortuna, había empezado a liberarse justo en esa habitación, donde la joven dormía. Si fuese el argumento de una película a mí me parecería inverosímil.
Ahora bien, cabe preguntarse: ¿por qué el monóxido de carbono asfixia? ¿Por qué no nos damos cuenta de que nos morimos y el cadáver parece dormir, hasta el punto de que esta muerte se ha ganado el sobrenombre de «muerte dulce»? La intoxicación por monóxido de carbono nos produce un sopor progresivo y, dado que el CO es un gas incoloro, insípido e inodoro, no nos damos cuenta de que lo estamos respirando juntamente con el oxígeno. Nos asfixiamos, sí, pero, paradójicamente, sin sensación de asfixia, puesto que el efecto que produce sobre la hemoglobina es progresivo.
Como seguramente sabrás, la hemoglobina es la proteína de la sangre encargada del transporte de oxígeno. Se trata de una ferroproteína, es decir, contiene hierro, que es el que posibilita que el oxígeno sea transportado. La hemoglobina presenta una estructura levemente distinta cuando se halla transportando oxígeno, en cuyo caso recibe el nombre de «oxihemoglobina» a cuando no lo está, es decir, «desoxihemoglobina«. A continuación tienes una imagen de cada una de estas hemoglobinas humanas:
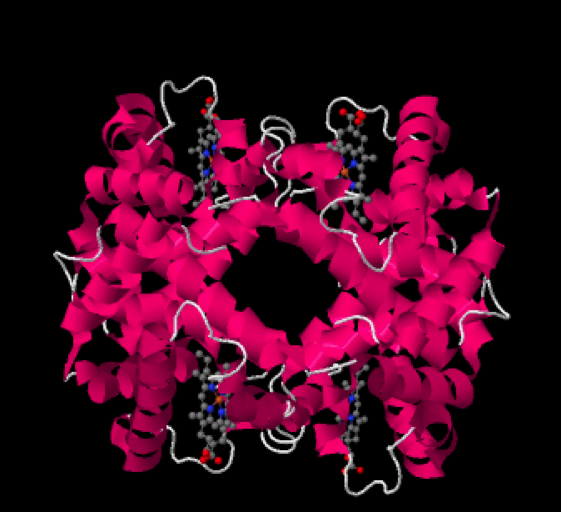
Desoxihemoglobina humana
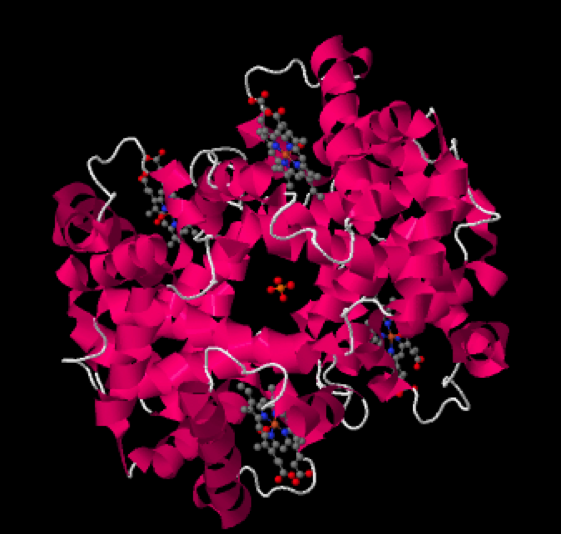
Oxihemoglobina humana
Las pequeñas estructuras que se observan en gris (los grises son átomos de carbono) con algunos átomos rojos (oxígenos) y azules (nitrógenos), entre las hélices de la proteína, reciben el nombre de grupos hemo.
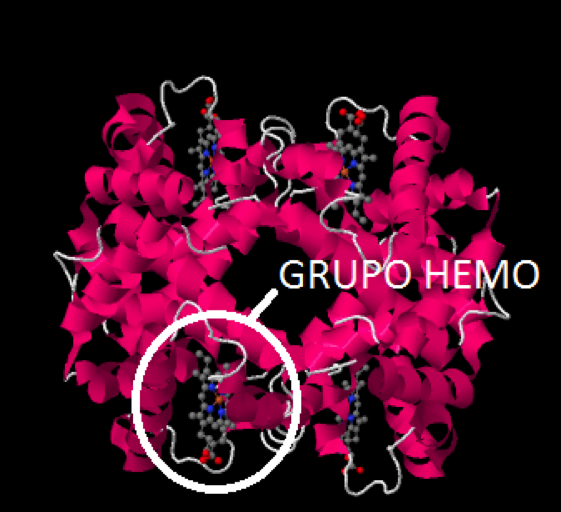
Grupo hemo de una desoxihemoglobina
Como ves, hay 4 grupos hemo en una molécula de hemoglobina, ya que la hemoglobina es en realidad un oligómero formado por cuatro subunidades, 2 subunidades llamadas alfa, y 2 subunidades llamadas beta. Es este grupo hemo el que posee un átomo de hierro y el que es capaz de transportar el oxígeno, uniéndose a él. Veamos una imagen de este grupo hemo, en la que se aprecia el llamado anillo porfirínico y el átomo de hierro (II) coordinado en el centro del mismo:
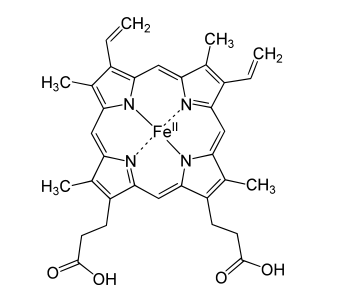
Química del grupo hemo
Este grupo hemo recibe el nombre de «grupo prostético», ya que no forma parte de la proteína (no está formado por aminoácidos, que son los monómeros que componen una proteína) y es el responsable del color rojo de la sangre.
De este modo, cuando la sangre transporta oxígeno desde los pulmones hasta los tejidos, este oxígeno se une al grupo hemo de la hemoglobina para su transporte.
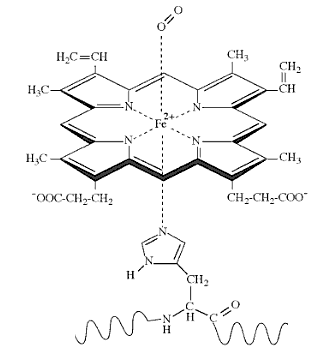
Unión de una molécula de oxígeno al hierro del grupo hemo
Sin embargo, ocurre que algunas sustancias, como es el caso del monóxido de carbono, CO, forman enlaces fuertes con el hierro del grupo hemo, lo bastante intensos como para desplazar al oxígeno, O2. El monóxido de carbono se une a la hemoglobina con una efectividad cientos de veces superior a la del oxígeno y resulta, además, irreversible, formándose carboxihemoglobina.
La fuerte unión del CO al grupo hemo interfiere con la capacidad de éste de realizar su función biológica de transporte y almacén de oxígeno, con resultados potencialmente letales.
Así, lo que sucede es que a medida que vamos respirando monóxido de carbono, éste se va uniendo progresivamente a las distintas moléculas de hemoglobina de nuestra sangre. La cantidad de oxígeno que reciben nuestros órganos y tejidos nos va sumiendo lentamente en un sopor que finalmente nos lleva a la muerte, cuando las necesidades de oxígeno de nuestro cerebro no son adecuadamente cubiertas.
También te puede interesar:
¿Se puede morir envenenado por la ingestión de almendras amargas?
Llegar al trono por la vía tóxica: el arsénico
Un veneno letal para conspiradores sibaritas: el polonio 210





Interesante… Tienes razón. si fuera un argumento de peli, jaja, ¡pero es real! Aquí en la Universidad de Navarra (donde estudié la Liecnciatura) pasó algo así: tras la última bomba de ETA, a la semana se produjeron intoxicaciones por la labor de mantenimiento: hubo algún «listillo» que en las cartas al director dijo que era CO, pero los síntomas que presentaba la gente eran distintos: fiebre, vómitos, mareos,… Parece que fue algo así como la «fiebre del fontanero» por algún compuesto de cobre o zinc, no lo recuerdo. Creo que lo buscaré.
Excelente entrada 😉
Ununcuadio, 12 Años Antes
Desde luego el tema de los efectos de los compuestos químicos sobre el organismo tiene algo de misterioso que atrae, al menos a mí me sucede, sobretodo cuando esos efectos se usan voluntariamente para cometer crímenes. Pronto escribiré una entrada nueva sobre algún otro veneno, ya que por ahora sólo tengo el arsénico… Un saludo 😀
Quimitube, 12 Años Antes
[…] La muerte dulce: asfixia por monóxido de carbono, CO […]
Un veneno letal para conspiradores sibaritas: el polonio 210 | Quimitube, 12 Años Antes