Contenido del Vídeo
En este tercer ejercicio resuelto de termoquímica vamos a determinar la variación de energía interna en la reacción de formación de amoníaco a partir del nitrógeno y del hidrógeno, es decir, la siguiente reacción:
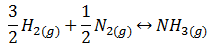
El enunciado completo es el siguiente:
Cuando se lleva a cabo la reacción entre el hidrógeno y el nitrógeno para dar amoníaco gaseoso, a 400ºC y en un recipiente cerrado, se desprenden 2,5 kJ de calor por cada gramo de amoníaco formado. Calcular la variación de energía interna del proceso, expresando el resultado en kJ/mol de NH3, y escribir la correspondiente ecuación termoquímica.
Como veremos se trata de un ejercicio sencillo en el que debemos recordar que la variación de energía interna de un sistema es igual al trabajo transferido a volumen constante. En este caso, se trata de dicho tipo de calor ya que la reacción se lleva a cabo en un recipiente cerrado.
También te puede interesar:
Transferencia de calor a volumen constante. Concepto de energía interna.
Primer Principio de la Termodinámica y su aplicación a las reacciones químicas
Y también:
Todos los vídeos de teoría de termoquímica
Todos los vídeos de ejercicios de termoquímica
Category: Ejercicios de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
se podría aplicar la ecuación de igualar la entalpia de la reacción H a la energía interna dado que el volumen es constante y siendo así decir que dado que la entalpía es 2,5kJ/grNH3 la energía interna seria lo mismo. Y al final convertirlo a kJ/mol NH3
Juan Camilo G., 11 Años Antes
Hola Juan Camilo, no, no podrías porque la entalpía es cuando la presión es constante, y no el volumen, de forma que no es cierto que sean iguales. De todos modos en este ejercicio no nos piden determinar la entalpía, sólo la energía interna, pero si quisieras calcular la entalpía deberías aplicar la fórmula que aplicamos en el ejercicio 5 y otros sucesivos:
http://www.quimitube.com/videos/termoquimica-variacion-de-energia-interna-en-el-proceso-de-combustion-del-propano/
QuimiTube, 11 Años Antes
Hola!!! Muchas gracias por subir los videos,y por todas tus explicaciones, me has esclarecido mucho los contenidos, te quería preguntar si en algún video (porque no he encontrado) explicas como se hace para resolver problemas de equilbrio ionico con balance de masa y carga, ya que así me lo piden en mi facultad, no lo he entendido y tengo hacer el recuperatorio del mismo y aprobar para promocionar!!! Desde muchas gracias!!!!!!!!!
Lucia, 10 Años Antes
¡Hola Lucía! Muchas gracias por tu comentario, me alegra mucho que te sirva el contenido. Todavía no tenemos nada de equilibrio con balances de masa, a ver si es posible subirlo más adelante, lo incluyo en la lista de pendientes. Mucha suerte y mucho ánimo con tus estudios.
QuimiTube, 10 Años Antes
Excelente los vídeos, voy por el 4 y me están ayudando un montón, gran logro ya que llevo muchísimo tiempo sin entender nada en química. Tengo una duda que seguramente sea de risa, por qué es N2 + H2 y no es N + H ??? Que determina el número que acompaña?? Gracias de antemano.
Gonzalo, 9 Años Antes
¡Hola Gonzalo! Lo que ocurre es que el nitrógeno y el hidrógeno son compuesto que siempre se encuentran formando moléculas de 2 átomos, N-N y H-H, lo cual escribimos como N2 y H2. Si escribieses N y H a secas estarías indicando que lo que tenemos son átomos sueltos de ambos elementos, lo cual no es cierto, siempre son moléculas. Espero que se comprenda. Un saludo y gracias por tu comentario.
QuimiTube, 9 Años Antes
Muchas gracias!!
Gonzalo, 9 Años Antes
Hola! Se podría haber ajustado la reacción de esta manera? :
N2 (g) + 3 H2 (g) ————> 2 NH3
Vanessa Maroto Juan, 8 Años Antes