Contenido del Vídeo
En el tema de Enlace Químico, concretamente al calcular la energía reticular de un compuesto iónico mediante el Ciclo de Born-Haber, hemos visto algunas variaciones de entalpía referidas a cambios físicos, como la entalpía de vaporización o la entalpía de sublimación. Vamos a ver en este apartado a qué hacen referencia estas entalpías.
Supongamos que tenemos 1 mol de agua a 20ºC. Este mol de agua tendrá una entalpía inicial H1, cuyo valor absoluto no podemos conocer porque sólo podemos calcular variaciones. Si este mol de agua lo calentamos hasta 50ºC a presión constante, harán falta aportar 2257 J en forma de energía calorífica. Como la entalpía es transferencia de calor a presión constante, la entalpía de este mol de agua habrá aumentado 2257 J, es decir, la ΔH será de 2257 J.
Si durante este calentamiento del agua llegamos a los 100ºC, entonces alcanzaremos el punto de ebullición del agua, y la temperatura permanecerá constante mientras se produce el cambio de fase de líquido a vapor; es decir, mientras se produce el cambio de estado. Que la temperatura permanezca constante durante el cambio de estado no implica que no estemos aportando calor al sistema, sino que este calor se está empleando en romper las fuerzas intermoleculares del agua líquida, los enlaces de hidrógeno entre las distintas moléculas de agua, para que pasen a estado vapor y no para aumentar la temperatura del agua. A este calor necesario a presión constante para romper todos los enlaces de hidrógeno del agua líquida se le llama Entalpía de vaporización o Calor de vaporización. En el agua se necesitan 40,7 kJ/mol de energía calorífica para que un mol de agua líquida a 100ºC pase a 1 mol de agua vapor a 100ºC (Nótese la gran cantidad de energía calorífica que se necesita para hervir el agua, 40700 J/mol, cuando para calentar esa misma cantidad de agua 30ºC, de 20ºC a 50ºC, bastan sólo, como hemos comentado, 2257 J, 18 veces menos).
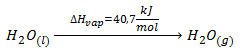
Si lo que tenemos es el proceso contrario, es decir, la condensación de 1 mol de agua vapor a 100ºC para dar 1 mol de agua líquida a la misma temperatura, se desprenden -40,7 kJ/mol.
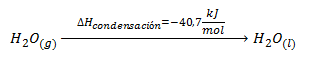
Es decir, las entalpías de vaporización y condensación de una sustancia tienen la misma magnitud pero signo contrario.
ΔHvap = -ΔHcond
Del mismo modo, cuando pasamos de un mol de sustancia sólida a un mol de sustancia líquida, al alcanzar el punto de fusión de dicha sustancia, el calor necesario para romper las interacciones que mantienen unido el sólido es el llamado Calor de fusión o entalpía de fusión SÍMBOLO, que, en el caso del agua, es de 6,02 kJ/mol. La entalpía de fusión es igual pero de signo contrario que la entalpía de solidificación.
ΔHfus = -ΔHsolid
Asimismo, algunas sustancias, como el yodo, pasan directamente de sólido a vapor sin pasar por el estado líquido. Al calor necesario para esto a presión constante se le denomina Entalpía de sublimación.
A continuación hallamos una tabla con las entalpías de cambio de estado de algunas sustancias juntamente con sus puntos de fusión y de ebullición.
Category: Teoría de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
No entiendo una cosa: al principio dice que la presión es constante. Sín embargo, en los dibujos aparecen los recipientes cerrados, o sea que el volumen es constante. Si se aumenta la temperatura, ¿entonces no debería aumentar la presión?
Guillermo, 11 Años Antes
Hola Guillermo, disculpa la confusión, mis dibujitos sólo pretenden ser un recipiente pero no indica que estén cerrados, son recipientes abiertos y por tanto a presión constante atmosférica.
QuimiTube, 11 Años Antes
Ok, muchas gracias por la aclaración 🙂 ¿Te puedo preguntar algo acerca de la entalpía de un ejercicio?
Guillermo, 11 Años Antes
Sí, por supuesto, si sé responderte te responderé 🙂
QuimiTube, 11 Años Antes
Bueno, el ejercicio dice que dos moles de isooctano se quema con oxígeno con 25 moles de oxígeno para dar 18 moles de agua y 16 moles de dióxido de carbono y dan un valor de delta de entalpía de la reacción (con el cero como superíndice, escrito pequeño arriba). Ese valor de variación de entalpía no entiendo cómo interpretarlo. ¿Es una entalpía de formación? De ser así, ¿no era que la entalpiá de formación era para formar un mol de compuesto? En el ejercicio dice que se forman 16 de CO2 y 18 de H20. ¿Cómo tengo que interpretar esto?
Guillermo, 11 Años Antes
¡Hola! Ese valor será la entalpía de combustión del isooctano, aunque sí que es cierto que normalmente se da también para 1 mol. Yo interpreto que el valor que te dan es para la combustión de 2 moles y que, por tanto, si quieres calcular el valor en kJ/mol debes dividir por 2.
QuimiTube, 11 Años Antes
Pero si ponen la variación de entalpía con un cero como superíndice, ¿no sería SIEMPRE el valor de combustión de UN mol? ¿O puede variar esto?
Guillermo, 11 Años Antes
No, el súper 0 te está indicando que estamos a 25ºC y 1 atmósfera de presión, no necesariamente que es para 1 mol, aunque en las tablas la entalpía estándar siempre venga para 1 mol.
Quimitube, 11 Años Antes
Ok, ¡muchas gracias!
Guillermo, 11 Años Antes
tengo una pregunta de un ejercicio de entalpia y cambio de estado, me puede ayudar??
Lady, 11 Años Antes
¡Hola! Podemos intentarlo, ¿cuál es tu duda?
QuimiTube, 11 Años Antes
Gracias!
un ejercicio dice:Que masa de hielo puede fundirse con una cantidad de calor coincidente con la necesaria para elevar la temperatura de 3.50 mol De agua liquida 50 grados celcius?
Entalpia estadar de fusion: 6.01 KJ/mol H2O (s)
para calcular el calor del agua liquida debo hacerlo con la ecuacion q= mxCxDelta de T? solo me da una temperatura y si con eso hallo el calor no entiendo como utilizar la entalpia estadar de fusion q me dan.
Lady, 11 Años Antes
Yo daría por hecho que el agua está inicialmente como hielo a 0ºC, así que necesitarás dos aportes de calor: el primero, para pasar de hielo a 0ºC a agua líquida a 0ºC (ahí es donde necesitarás la entalpía estándar de fusión, que transcurre a temperatura y presión constantes), y el segundo, para pasar de agua líquida a 0ºC a agua líquida a 50ºC, lo cual se calcularía con la fórmula que tú has indicado, q = m·c·DT.
QuimiTube, 11 Años Antes
Ahhhh bueno, Muchisimas gracias!!!
Lady, 11 Años Antes
que pena… bueno, ya halle los calores pero no se si debo igualarlos? para hallar los gramos de agua. porque no veo de que otra forma relacionarlos
Lady, 11 Años Antes
Hola, yo quería saber cómo puedo calcular la variacion de entalpía cuando aumenta o disminulle la temperatura. Gracias!
Cesar Fernandez, 11 Años Antes
Hola César, deberás disponer de una ecuación que relacione DH frente a T, que generalmente te darán en el enunciado del problema.
QuimiTube, 11 Años Antes
hola, necesito ayuda para calcular la entalpia del n-hexano a 100 ºc y 1 bar estado liquido, tomando como estado de referencia n-hexano a 100 ºc y 1 bar en estado gas
rafael, 10 Años Antes
Hola Rafael, necesitarías las entalpías de formación del n-hexano en ambos estados, pero yo no dispongo de dicho dato.
QuimiTube, 10 Años Antes
Muy buen vídeo es de mucha ayuda 🙂
jonathan, 9 Años Antes
¡Muchas gracias!
QuimiTube, 9 Años Antes
Hola:
Si la condensación del agua libera tanta energía (-40 kJ/mol), me preguntaba si este es el origen de la energía de los rayos en las tormentas…
… y esta es la única duda que me surge… pues es q explicas tela de bien! 🙂
GRACIAS!
Belén, 9 Años Antes
holaaa, y si me dicen cual es la diferencia de entalpías entre s-l DEL AGUA sin ningún dato.
GRACIAS
GENSIS, 4 Años Antes
¡Hola! Necesariamente tienes que buscar en una tabla de entalpías los valores para el hielo y el agua líquida, si no no puedes responder…
QuimiTube, 4 Años Antes