Contenido del Vídeo
A partir de las entalpías de formación de los distintos compuestos que intervienen en una reacción química es posible calcular la entalpía o variación de entalpía de dicha reacción. Consideremos la reacción global de un reactivo A con un reactivo B, para dar un producto C y un producto D.
La variación de entalpía de esta reacción, por ser una función de estado, será la entalpía del estado final menos la entalpía del estado inicial, es decir, la entalpía de formación de los productos menos la entalpía de formación de los reactivos. Como las entalpías de formación se estandarizan para un mol de compuesto formado, debemos multiplicar dichas entalpías de formación por los coeficientes estequiométricos correspondientes de cada compuesto:

Y como:
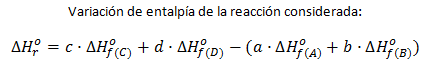
Y, de forma general, se puede expresar del siguiente modo:

Que es la fórmula que emplearemos, en general, para el cálculo de la energía de una reacción química a partir de los valores de entalpía de formación de los reactivos y de los productos.
En el vídeo explicaremos, asimismo, cómo aplicar dicha fórmula a la reacción de combustión del benceno, es decir:
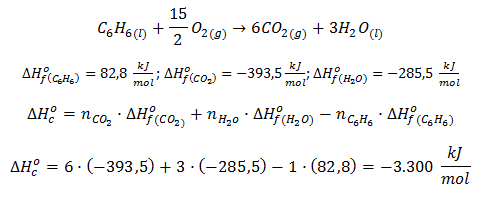
Del mismo modo, cabe destacar que con esta fórmula es posible calcular la entalpía de formación de un compuesto conociendo la entalpía de la reacción y la entalpía de formación de los compuestos restantes; esto se verá con mayor detenimiento en los ejercicios de termoquímica resueltos.
A continuación se muestra una tabla con los valores de entalpías estándar de formación (a 25ºC y 1 atm). Se puede descargar como imagen clicando sobre ella, o en PDF en el enlace inferior.
Tabla de valores de entalpías de formación estándar de diversos compuestos en PDF
También te pueden interesar los siguientes vídeos teóricos previos (9 y 10):
Definición de entalpías de reacción estándar. Reacciones exotérmicas y endotérmicas.
Definición de entalpía de formación y ejemplos
Category: Teoría de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad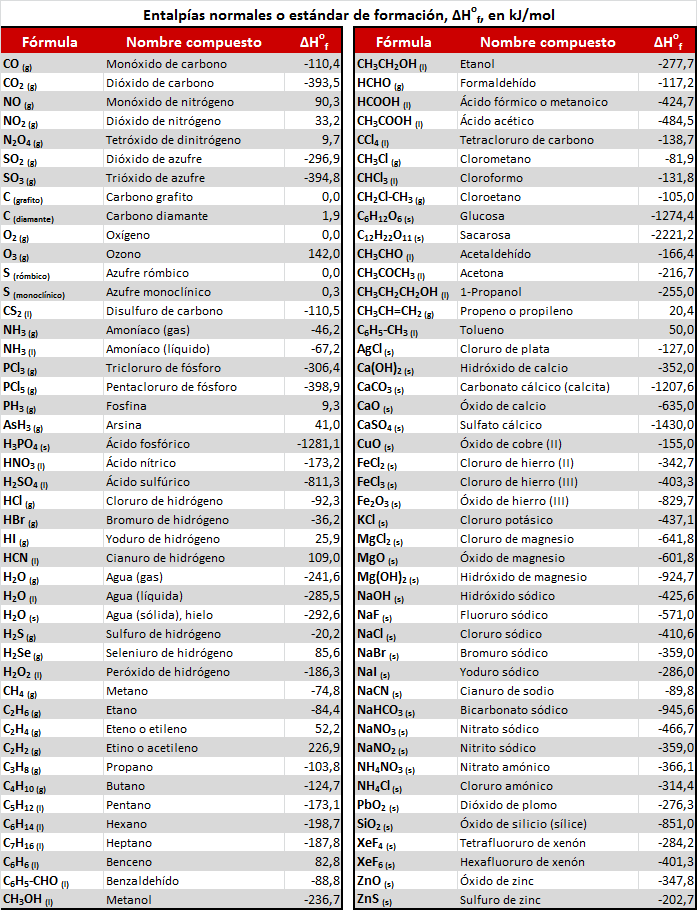
Hola! Como se ajustas este tipo de reacciones, separando sus semirreacciones redox y reduciendo luego??
Clickaqui, 11 Años Antes
Profe muy buena la página.
En esta clase, la letra es muy pequeña y no se ve bien 😉
adri, 11 Años Antes
¡Hola! Me alegro de que te guste la página 🙂 Pronto tendremos algunas mejoras que permitirán que los vídeos ganen en calidad, ¿pero has probado a ponerlo en HD? Un saludo
QuimiTube, 11 Años Antes
tengo un problema que es como sigue:el cambio estandar de entalpia para la reaccion de oxido de cobre(s)(II) +hidrogeno (g)—-> cobre(s) + agua(l) es de -130,6 kj. calcule el calor de formacion estandar de oxido de cobre… y nose como resolverlo…
tania, 11 Años Antes
¡Hola Tania! Cuando se trata de calcular el calor de formación sabiendo la entalpía de una reacción y las entalpías de formación restantes se usa la misma fórmula, sólo que lo que debes despejar es la entalpía de formación que tendrás como incógnita. Puedes ver un ejemplo de esto aquí: http://www.quimitube.com/videos/termodinamica-ejercicio-21-calcular-la-entalpia-de-formacion-del-no-a-partir-de-otras-entalpias-de-formacion/ y aquí http://www.quimitube.com/videos/termodinamica-ejercicio-22-calcular-la-entalpia-de-formacion-del-etano/
QuimiTube, 11 Años Antes
Hola! una pregunta, cuando dices «compuesto puro» al referirte al oxígeno por ejemplo, ¿no querrás decir un comp. puro, pero concretamente un «elemento»?es decir, sé que es un compuesto puro, pero el agua también es un compuesto o substancia pura, solo que no un «elemento». No sé si me explico bien,jeje :)) Gracias por los vídeos, son geniales
Maite, 11 Años Antes
¡Hola Maite! Bienvenida 🙂 Tienes toda la razón, sería mejor decir elemento puro para evitar confusiones, tengo la «manía» de decir sustancia pura para referirme a elemento cuando no es siempre así. Un saludo grande.
QuimiTube, 11 Años Antes
Hola que tal, muchas gracias por subir estos videos.
Cuando estás calculando la entalpía de reacción a partir de las entalpías de formación no se debería poner en Julios en vez de Julios/mol, ya que en la fórmula multiplicas por los coeficientes de las sustancias.
Gracias
Gonzalo, 11 Años Antes
gracias por ayudar al subir estos videos 😀
espero sigas haciendolos, son muuy útiles
gracias
dambrielly, 11 Años Antes
Muchas gracias por tu comentario, me alegro de que te sirvan 🙂
QuimiTube, 11 Años Antes
Que tal, ¿como estas? me fue de gran utilidad tu explicación en el vídeo calculo de entalpias y la tabla de valores en pdf, gracias, lo aplicare en el desarrollo de mis clases de química en el nivel de bachillerato, animo!
Anselmo SRL…
Anselmo SRL..., 11 Años Antes
Hola Anselmo, muchísimas gracias por el apoyo, siempre se puede mejorar pero intentaremos que las explicaciones vayan siendo cada día un poquito mejores. Un saludo muy grande.
QuimiTube, 11 Años Antes
* buenas!! acabe bachillerato hace varios años pero mi novio esta examinandose ahora y me ha pedido ayuda, me he puesto a repasar un poco y con estos videos es super facil. Ayudas mucho y te explicas genial. Enhorabuena y gracias por hacer que una cosa q unos pocos entendemos y parece rara este al alcance de muchos. Sigue asi
eugenia, 11 Años Antes
Hola;
Una pregunta, cuando tienes «A+B—-> C» pero no encuentras en tablas la entalpia de formación de C, como la puedes obtener???
Saludos cordiales
Daniel, 11 Años Antes
¡Hola! Normalmente en ese caso te dan la entalpía de la reacción, de forma que tu única incógnita sería la entalpía de formación de C. Si por el contrario no encuentras el valor en las tablas y tampoco te dan la entalpía de reacción, necesitarías otras reacciones relacionadas para poder hacer el cálculo a partir de la ley de Hess. Un saludo.
QuimiTube, 11 Años Antes
muchas gracias muy util!!!!
guillermmo, 11 Años Antes
Gracias 🙂
QuimiTube, 11 Años Antes
oye no se si me equivoque pero creo que esta mal balanceada la ecuación en la primer parte o por lo menos no entiendo por que es 15/2 debería ser 15 oxígenos. de resto muy útil el video muchas gracias me sirvió bastante.
Diego, 11 Años Antes
¡Hola Diego! Lo que ocurre es que no tienes solo O, sino O2, así que para el ajuste debes multiplicar el coeficiente estequiométrico que pongas por 2. Como queremos tener 15 oxígenos, tenemos que poner 15/2 porque al multiplicar por 2 los doses se simplifican y nos queda 15. Siempre que en una reacción de combustión necesites ajustar un número impar de oxígenos tienes que ponerlo como fracción: 7/2, 9/2, 11/2…
QuimiTube, 11 Años Antes
COMO ME ENCANTA ESTE TEMA, MUY BUENA EXPLICACIÓN 😀 Love quimica
quimicalove, 11 Años Antes
Muy buen video! Hace poco estaba hecha un lio con estas cosas..me has ayudado mucho de verdad 🙂
Rocio, 10 Años Antes
Hola Rocío, muchas gracias, me alegra mucho que te haya servido 🙂 Un abrazo grande.
QuimiTube, 10 Años Antes
En la entalpía, cualquier elemento alotrópico es igual a «0» ?? O no. O a cual??
shio, 10 Años Antes
En general cualquier elemento puro lo tomamos como 0, o al menos si en el enunciado no te lo dicen tú tómalo como cero. Existen alótropos que no son cero, como el carbono diamante (el que es cero es el carbono grafito) pero te lo tendrían que indicar expresamente en el enunciado, de lo contrario tómalo como 0.
QuimiTube, 10 Años Antes
Que se considera cuando se estudia los valores de entalpía de formación??
rocio, 10 Años Antes
A lo mejor te resulta bien ver primero el vídeo de teoría de entalpías de formación, estás en un vídeo posterior. Mira mejor este:
http://www.quimitube.com/videos/termodinamica-teoria-10-definicion-de-entalpia-de-formacion-y-ejemplos
QuimiTube, 10 Años Antes
Para reconocer la entalpía de combustión estándar se deben conocer????
rocio, 10 Años Antes
¡Hola! Esta es una forma de calcularlo, habrá otras, como la Ley de Hess, pero no te preocupes porque te van a dar los datos que necesites en el enunciado, por supuesto no tienes en ningún caso que saber estos valores de memoria.
QuimiTube, 10 Años Antes
Hola! Muchisimas gracias por tus videos! Son de gran utilidad!
Tengo una duda: yo pensaba que al calcular la entalpia de formacion solamente habia que sumar la entalpia de los gases, y que la de los solidos y liquidos no contaba! En que casos ocurre esto??
Isa, 10 Años Antes
¡Hola! En el cálculo de la entalpía a partir de entalpías de formación tienes que tener en cuenta todos los componentes, independientemente de su estado de agregación (tal y como efectivamente vemos en el vídeo). Quizá te estés confundiendo con el cálculo de la constante de equilibrio, ¿es posible? Un saludo grande.
QuimiTube, 10 Años Antes
HOLA, ME SIRVIO DE MUCHA AYUDA ESTA PAGINA Y TAMBIEN L EXPLICACION DE LA SEÑORA
LINA MARCELA, 10 Años Antes
¡Hola! Muchas gracias, me alegra que te sirviera. Un saludo grande.
QuimiTube, 10 Años Antes
Hola! muy bueno tus videos, tengo una duda/consulta… cuando me dan el calor de combustión de una sustancia, y me piden calcular la entalpía de formación de esa sustancia a presión constante….. DEBO TOMAR ESE CALOR DE COMBUSTIÓN COMO VARIACION DE ENTALPIA O VARIACIÓN DE ENERGIA INTERNA??
No sé si me explico, leí q los procesos de combustión se realizan a volumen constante entonces el calor q me proporcionan como dato, sería la variación de energia interna. Entonces no sé si directamente despejar el calor de formación del calor de combustión, o calcular la variacion de entalpía y recien de ahí despejar el calor de formación. MUCHAS GRACIAS DESDE YA
Alexander, 10 Años Antes
¡Hola! Normalmente lo tomamos siempre como VARIACIÓN DE ENTALPÍA y no como variación de energía interna. No sé dónde leíste que los procesos de combustión se dan a volumen constante, pero son más frecuentes a presión constante y con volumen variable porque en las combustiones hay desprendimiento de gases que se liberan a la atmósfera (por ejemplo en la combustión de la gasolina de un coche, o cuando quemamos madera en una chimenea). Así, tómalo como variación de entalpía y de ahí podrás despejar la entalpía de formación. Un saludo.
QuimiTube, 10 Años Antes
Buen dia, si me pide calcular cuanto calor produce 3 moles de NaCl en una determinada reaccion, solo tengo que multiplicar por 3 su entalpia de formacion?
Lucia, 9 Años Antes
Hola Lucía, sí, si la reacción que te indican es la de formación. Si es en otra reacción distinta, primero tendrías que calcular la entalpía de dicha reacción y luego multiplicar po 3. Por ejemplo, te podrían pedir esta:
NaOH + HCl = NaCl + H2O
Y darte como datos las entalpías de formación de los distintos compuestos para que apliques lo que hemos visto en este mismo vídeo.
Espero haberte servido de ayuda. Un saludo.
QuimiTube, 9 Años Antes
estudio en la mejor universidad de mi país (universidad nacional de Colombia) y he visto 1 de cada 20 profesores que tienen que la vocación que tu tienes. Gracias desde Colombia, y desde muchas universidades del mundo
nicola tesla/1000, 9 Años Antes
Qué bonito comentario, ¡muchas gracias! Es cierto que tener vocación por la enseñanza hace que uno explique con más ilusión, ciertamente yo me siento ilusionada con las clases. Un saludo grande hasta Colombia.
QuimiTube, 9 Años Antes
Hola
Buen día
Me puedes ayudar con este ejercicio
Ca (oh)²+65.3kj=CaO+ h2o.
Cómo cálculo la entalpía con ese kj ahí ?
Tania, 4 Años Antes
¡Hola! Lo que quiere decir es que para que el Ca(OH)2 pase a CaO + H2O tienes que aportar 65,3 kJ de energía, por lo que ya tienes el valor de la entalpía, es el propio dato que te dan.
QuimiTube, 4 Años Antes
saludos. que excelente canal. una pregunta …. por que en el caso de sustancia pura h = u +pv y en el caso de gases ideales h = cpxt
claudio arrieta, 4 Años Antes
Hola Claudio, esto que preguntas es de mayor nivel que los contenidos que tenemos en nuestra página. Te sugiero echar un vistazo a los apartados de termodinámica de aquí: http://www.sc.ehu.es/sbweb/fisica_/estadistica/estadistica.html#termodinamica
Un saludo.
QuimiTube, 4 Años Antes