Contenido del Vídeo
Como hemos dicho en el primer apartado introductorio sobre termoquímica los procesos químicos y físicos de las sustancias llevan asociados cambios o variaciones de energía, y la forma de energía más habitual de dichas variaciones es como calor o energía calorífica. El intercambio de calor entre un sistema y su entorno se produce como consecuencia de una diferencia de temperatura, por ejemplo:
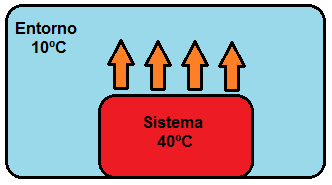
Siempre se produce un flujo de calor desde el elemento de mayor temperatura al de menor temperatura. En concreto, la transferencia de calor, Q, que experimenta un sistema formado por una sustancia pura depende de:
- La variación de temperatura que experimenta, ΔT
- La masa de la sustancia, m
- La naturaleza de la sustancia. De dicha naturaleza dependen dos parámetros que vamos a definir a continuación, la capacidad calorífica específica y la capacidad calorífica molar.
Capacidad calorífica específica o calor específico de una sustancia
La capacidad calorífica, c, o calor específico, es la energía calorífica necesaria para aumentar 1ºC o 1K (si hablamos de incrementos es lo mismo) la temperatura de 1kg de masa de una sustancia a una presión de 1013 hPa, En el SI se expresa en J/kg·K y es una propiedad característica de las sustancias.
Esto significa que para que un kg de agua aumente 1ºC su temperatura a presión normal, se han de suministrar 4180 J de energía calorífica.
En general, conociendo la masa de sustancia, m, la variación de temperatura que experimenta, ΔT, y su capacidad calorífica específica se puede calcular la energía calorífica intercambiada o transferencia de calor, Q, según la fórmula:
Q=m·c·ΔT
Donde:
m = masa de la sustancia
c = capacidad calorífica específica (J/K·kg)
ΔT = Tf – Ti (temperatura final menos temperatura inicial del sistema)
Por ejemplo, para calentar una barra de 6kg de aluminio de 25ºC a 40ºC, sabiendo que la C del aluminio es de 895 J/kg·K
Q = m·c·ΔT = 6 kg · 895 (J/K·kg) · (40-25) = 80550 J
Capacidad calorífica molar de una sustancia
La Capacidad calorífica molar, Cm, es la energía calorífica necesaria para aumentar 1K o 1ºC la temperatura de un mol de cualquier sustancia. En este caso, la transferencia de calor será:
Q= n·ΔT·Cm
Donde:
n = número de moles
Cm = capacidad calorífica molar
ΔT = Tf – Ti (temperatura final menos temperatura inicial del sistema)
Cabe destacar que para el caso de sólidos y líquidos, la capacidad calorífica específica y la capacidad calorífica molar son iguales tanto si el proceso se realiza a presión constante como se se realiza a volumen constante. No obstante, en el caso de los gases, estos parámetros varían, lo cual se indica con un subíndice v y p para el proceso a V=cte y P=cte respectivamente: Cv, Cp, Cmv, Cmp, por lo que si en un ejercicio debemos calcular el calor transferido en el caso de un gas nos deben indicar si el proceso es isocoro o isobárico.
Category: Teoría de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Hola, estoy iniciando la universidad desde un acceso para mayores de 25 años y me siento muy perdida, pero con tus vídeos poco a poco voy comprendiendo cada vez más la química, muchas gracias por tus valiosas aportaciones.
Melissa Pérez, 11 Años Antes
Muchas gracias Melissa y bienvenida. Ánimo con el acceso porque es duro prepararse cuando uno se siente un poco perdido, pero espero que te vaya fenomenal. Un saludo muy grande.
QuimiTube, 11 Años Antes
Muhas gracias! muy biene explicado la leccion! 😉
Sachet, 11 Años Antes
MUCHAS GRACIAS ESTA SUPER CLARO
DORBITA, 11 Años Antes
Gracias a ti por comentar y bienvenida.
QuimiTube, 11 Años Antes
necesito ayuda con este problema con el que me eh atorado
Ejercicio 10.
En una muestra de un gas, la diferencia en las capacidades caloríficas a presión constante y a volumen constante es de 21.6 J/K. Halle: (a) el número de moles; b) la capacidad calorífica a presión constante sabiendo que el gas es diatómico (haltera rígida).
espero y me puedas ayudar
Arturo, 11 Años Antes
Hola Arturo, lo lamento, veo que este problema es de nivel universitario y me resultaría complicado ayudarte ahora mismo. ¿Lo has empezado a plantear? Un saludo.
QuimiTube, 11 Años Antes
En un gas diatomico la capacidad calorifica a volumen constante es 5/2nR y la capacidad calorifica a presion constante es 7/2nR. Por tanto la diferencia entre las dos sera nR y te dicen que es 21.6 J/K.
Asi n sera 21.6/8.314 es decir unos 2.6 moles de gas diatomico. Y Cp sera 7/2*2.6*8.314 unos 75.7 J/K. Un saludo
Antonio, 11 Años Antes
Hola Antonio, bienvenido. Gracias por la explicación detallada, aunque en este vídeo no hemos tenido en cuenta gases diatómicos no está de más indicarlo. Un saludo.
QuimiTube, 11 Años Antes
Gracias a ti por tus videos. Esta todo muy bien explicado. Los recomendare a mis alumnas y alumnos. Un saludo
Antonio, 11 Años Antes
Necesito ayuda con este problema por favor.
Calcular el calor producido al quemar u oxidar el combustible que utilizo en casa.
Si utilizo 1 tanque de 20kg de gas licuado de petroleo ( propano)
A) Escribir la escuacion química balanceada
B) Reduvimos los números de balanceo de la educación a su mínima expresión
C) representamos cada uno de los compuestos en la reacción química con su formula desarrollada.
Ronaldo, 11 Años Antes
¡Hola! Se trata de la reacción de combustión del propano, C3H8. Te servirá ver este otro ejercicio con el butano porque será muy parecido:
http://www.quimitube.com/videos/termodinamica-ejercicio-11-ecuacion-termoquimica-de-combustion-del-butano-y-energia-de-una-bombona/
QuimiTube, 11 Años Antes
Creo q gracias a quimitube voy a aprobar la química!! Muchas gracias por tus vídeos, son muy buenos
Ro, 11 Años Antes
Muchas gracias por tu comentario, espero que así sea, que apruebes química y no la veas como una asignatura difícil 🙂 Un abrazo.
QuimiTube, 11 Años Antes
Hola! Muchisimas gracias por todas las explicaciones, son muy claras y entendibles. Estoy en segundo de bachillerato, y en la primera evaluacion he sacado un 9. Estoy segura de que si sigo viendo estos videos, y con un poco mas de esfuerzo por mi parte, podre llegar al 10. Un saludo
Ana, 11 Años Antes
¡Hola Ana! Qué bien, un 9. Y si has llegado al 9 en la primera evaluación no tengo dudas de que llegarás al 10 🙂 Un saludo y muchas gracias por tu comentario.
QuimiTube, 11 Años Antes
Hola, gracias por los vídeos. Son geniales. Hay una cosa que no entiendo. Si el Q queda definido por la siguiente expresión Q=m·c·ΔT, por qué en los procesos isotérmicos este no se anula si está multiplicado por su diferencial, y sinembargo queda la expresión: Q=-W. Muchas gracias de antemano.
Belén, 11 Años Antes
¡Hola! Realmente en un proceso isotérmico el cálculo de Q no es tan sencillo, el proceso isotérmico suele referirse a transferencias de calor muy lentas, lo que hace que la temperatura no varíe, sino que se aproveche, por ejemplo, para la expansión del gas (W, trabajo de expansión, de ahí Q=-W). Sin embargo, el cálculo no es trivial y se escapa de los contenidos del curso, como verás aquí: http://es.wikipedia.org/wiki/Proceso_isot%C3%A9rmico
Un abrazo.
QuimiTube, 11 Años Antes
hola, soy de Colombia, me gustan mucho tus videos, la teoría la explicas excelentemente, pero los ejercicios me parecen muy fáciles, aunque necesarios, ¿podrías agregar también ejercicios de mayor complejidad? de los más dificiles que puedas, es que veras, tus videos me ayudan a comprender parte, pero cuando me enfrento a los problemas propuestos en mi U, no soy capaz…..
andrey, 11 Años Antes
¡Hola! Espero que más adelante podamos añadir estos contenidos. Lo que ocurre es que los temas no están desarrollados para nivel universitario, sino para el último curso antes de entrar en la universidad y el nivel no es tan elevado. Un saludo.
QuimiTube, 11 Años Antes
Tengo un par de dudas con respecto a la capacidad calorifica ! Mira si yo me encuentro con un material que me da capacidad calorifica negativa y muy grande significa que ese material es incapaz de retener mucho calor y lo pierde mas rapido que otro con capacidad calorifica positiva ??? (esto en el transcurso del tiempo digo)
emiliano !, 10 Años Antes
¡Hola! ¿Como por ejemplo qué material? La verdad es que no me he encontrado nunca con un material que tenga capacidad calorífica negativa, pero imagino que efectivamente tiene que ser algo así, que tenga una facilidad muy muy grande para la transmisión de calor.
QuimiTube, 10 Años Antes
Muy buena explicación, mas claro no se podría!
Excelente video 🙂
Carlos Gonzalez, 10 Años Antes
¡Muchas gracias Carlos! Bienvenido 🙂 Un saludo.
QuimiTube, 10 Años Antes
me encanto tu video, explicas todo tan simple y ademas de guapa, estoy en la universidad y me has sido de gran ayuda, un beso.
zuri, 10 Años Antes
Muchas gracias por tu comentario, me anima a continuar 🙂 Un saludo grande
QuimiTube, 10 Años Antes
Mil gracias por esa dedicación, solo con ese cariño a la química se puede transmitir tan claramente.
Vengo viendo los videos por orden y en el caso de la energía mecánica (w) aclaraste que el trabajo no era una función de estado, he supuesto que en este caso la energía calorífica (Q) no es una función de estado tampoco, pero… me gustaría tu confirmación.
Un abrazo
Carina, 10 Años Antes
Hola Carina, muchas gracias por tu comentario, me anima a continuar con los contenidos. Efectivamente el calor no es una función de estado tampoco, al igual que el trabajo. Un saludo grande.
QuimiTube, 10 Años Antes
Voy a presentar mi examen de ingreso a la universidad y la verdad es que los vídeos de esta pagina me han ayudado mucho a despejar varias dudas que tenia y a entender unos temas que la verdad no me entraban en la cabeza muchas gracias por esta excelente labor
Liseth, 9 Años Antes
Muy buenas tus explicaciones. Necesito hacer una consulta, las unidades de capacidad calorífica son J/K Kg o KJ/ K Kg o J/K g. Buscando datos encuentro que lo expresan como J/ K g. Muchas gracias
norma, 9 Años Antes
¡Hola Norma! Todas serán válidas, pero si estamos trabajando estrictamente en el sistema internacional entonces son las últimas que indicas, J/K·g. Un saludo.
QuimiTube, 9 Años Antes
Muchas gracias por tu respuesta. Te felicito porque eres muy didáctica en tus explicaciones. Desde Argentina un abrazo
norma, 9 Años Antes
Hola,necesito ayuda tengo un problema donde tengo que calcular la cantidad de calor que se suministra para 2lts de agua si el agua esta a 22 grados y llegue a 78grados
Vale, 9 Años Antes
Hola, debes usar la fórmula tal y como la ves ahí, Q = m·C·DT, ya tienes la masa (2 litros de agua son 2000 gramos) y tienes la variación de temperatura. Tendrás que buscar la capacidad calorífica, c, y tu única incógnita será Q.
QuimiTube, 9 Años Antes
Hola nose nada bsolutamnete nada d este tema.. mse cm se hace este problema
cual es la masa de un cuerpo cyyo calor eapecifico 0.15 cal / g C si su capacidad calorifica ea de 300 cal /°C
haydee, 9 Años Antes
Hola, te sugiero que veas el vídeo y te leas con detenimiento la explicación a pie de vídeo. Como verás, la fórmula que has de aplicar es Q=m·c·ΔT.
QuimiTube, 9 Años Antes
Un objeto que posee una capacidad calórica c = 0.5 cal/g°C sufre un incremento en su temperatura de 30°C, luego de añadírsele 60 calorías ¿Cuál es la masa del cuerpo?
Su ayuda con la fórmula gracias de antemano
Nicolay, 9 Años Antes
Hola Nicolay, tal y como explicamos en el vídeo, que te sugiero que veas en su totalidad, y también en la explicación escrita (que puedes leer completa) la fórmula es Q = m·c·DT. En el vídeo verás cómo aplicarla. Un saludo.
QuimiTube, 9 Años Antes
hola , tengo una duda, aca en un libro he encontrado que
(calor especifico=Capacidad calorifica a volumen constante/masa)….
entonses seria
(Q a volumen constante= masa x calor especificox variacion de temperatura)
entonses habria una diferencia entre calor especifico y capacidad calorifica a volumen constante
y usted pone: Q= m x cc.x variacion de temperatura
quisiera que me aclare por que la diferencia?
por fa gracias
kenlly, 9 Años Antes
¡Hola! ¿Te hace referencia a gases o a sólidos y líquidos? Ten en cuenta lo que decimos en el último párrafo de nuestra explicación:
«Cabe destacar que para el caso de sólidos y líquidos, la capacidad calorífica específica y la capacidad calorífica molar son iguales tanto si el proceso se realiza a presión constante como se se realiza a volumen constante. No obstante, en el caso de los gases, estos parámetros varían, lo cual se indica con un subíndice v y p para el proceso a V=cte y P=cte respectivamente: Cv, Cp, Cmv, Cmp, por lo que si en un ejercicio debemos calcular el calor transferido en el caso de un gas nos deben indicar si el proceso es isocoro o isobárico.»
QuimiTube, 9 Años Antes
HOLA MUCHAS GRACIAS, POR TU AYUDA
BRUCE, 9 Años Antes