Contenido del Vídeo
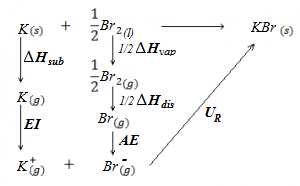
En el siguiente ejercicio calcularemos la energía reticular del bromuro potásico, KBr, a partir del ciclo de Born Haber, utilizando para ello los datos siguientes:
ΔHf (KBr) = -391,8 kJ/mol
(entalpía de formación del bromuro potásico, energía desprendida cuando se forma un mol de bromuro potásico a partir de sus elementos en estado natural, es decir, potasio sólido metálico y bromo diatómico líquido)
ΔHvap (Br2) = 30,7 kJ/mol
(entalpía de vaporización del bromo, es decir, energía necesaria para pasar de líquido a vapor).
ΔHdis (Br2) = 193,5 kJ/mol
(entalpía de disociación del bromo, es decir, energía necesaria para pasar de molécula diatómica gaseosa a átomos individuales gaseosos, Br2(g) –> 2Br(g)).
ΔHsub (K) = 81,3 kJ/mol
(entalpía de sublimación del potasio, energía necesaria para pasar de potasio sólido a potasio gaseoso).
EI (K) = 418,4 kJ/mol
(energía de ionización del potasio, energía necesaria para ionizar el potasio, abstrayendo el electrón de valencia y pasando a catión potasio, K+).
AE Br = -321,9 kJ/mol
(afinidad electrónica del bromo, energía desprendida cuando un átomo de bromo en estado gaseoso capta un electrón para pasar a anión bromuro, Br-).
También te pueden interesar los ejercicios siguientes:
Ciclo de Born-Haber para el fluoruro sódico, NaF
Cálculo de la energía reticular del óxido de magnesio, MgO, por el Ciclo de Born-Haber
Cálculo de la afinidad electrónica del cloro por el Ciclo de Born-Haber
Demostrar la no existencia del compuesto NaO con el Ciclo de Born-Haber
Category: Enlace Químico y Vídeos de Ejercicios de Enlace Químico.
Etiquetas: Ciclo de Born-Haber y Enlace iónico.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
excelentes ejercicios y sobre todo bien explicados. felicidades
ANGELICA ARENAS MITRE, 11 Años Antes
Muchas gracias y bienvenida, me alegra que te sirvan. Un saludo.
QuimiTube, 11 Años Antes
bUENAS MARIA. ME HE ENCONTRADO EL EJERCICIO DE SELECTIVIDAD DEL AÑO 2006 » A) Representa el ciclo de Born-Hber para el bromuro de sodio?
b )Exprese la entalpía de formación (ΔHf) del bromuro de sodio en función de las siguientes variables: la energía de ionización (I) y el calor de sublimación (S) del sodio, la energía de disociación (D) y la afinidad electrónica (AE) del bromo y la energía reticular (U) del bromuro de sodio. EL APARTADO A LO SE HACER PERO EL B) NO ENTIENDO PORQUE NO PONE LA ENTALPIA DE EVAPORACIÓN. ¿nO SE TIENE EN CUENTA Y SUPONEMOS QUE EL BR ES GASEOSO O SE PONE AUMQUE EL EJERCICIO NO LO PONGA?. GRACIAS UN SALUDO
JOSE, 11 Años Antes
¡Hola! Tienes razón, resulta un poco chocante que no te den el dato de la entalpía de evaporación (como en este ejercicio resuelto en el que comentas) ya que el bromo, Br2, es líquido a temperatura ambiente. Prueba a hacerlo dando por hecho que te están dando directamente el bromo gaseoso y no líquido, a ver qué valor obtienes. Un saludo.
QuimiTube, 11 Años Antes
Muchas gracias me a servido mucho, muy bonita la profe
william, 8 Años Antes