Contenido del Vídeo
La geometría molecular y el estudio del enlace químico son muy importantes a la hora de comprender y describir las propiedades macroscópicas de los compuestos covalentes (puntos de fusión y ebullición, por ejemplo). Así, uno de los modelos empleados para la descripción del enlace covalente es el llamado Modelo del Enlace de Valencia, el cual fue desarrollado por Heitler y London en 1927. Este modelo se basa en suponer que la formación del enlace covalente se da cuando dos orbitales atómicos semiocupados, es decir, cada uno ocupado por un único electrón, penetran entre sí y los espines electrónicos de ambos electrones se aparean. Cuando mayor es esta interpenetración o solapamiento, más fuerte es el enlace covalente formado.
El solapamiento se puede dar de dos formas: solapamiento frontal o solapamiento lateral. Si el solapamiento de los orbitales atómicos es frontal, tendremos un enlace de tipo sigma, correspondiente a un enlace simple; si el solapamiento es lateral, tendremos un enlace de tipo pi, correspondiente a un enlace doble o triple.
Enlace sigma
En este enlace el solapamiento es frontal, es decir, los orbitales atómicos se hallan situados sobre el mismo eje del enlace. Se da entre dos orbitales s, dos orbitales p, un orbital s y un p o también entre orbitales híbridos (sp, sp2, sp3). Puesto que el solapamiento de los dos orbitales es grande (gran interpentración) los enlaces de tipo sigma son enlaces fuertes que desprenden mucha energía al formarse y, por tanto, requieren mucha energía para romperse.
Veamos algunos ejemplos de solapamiento orbital:
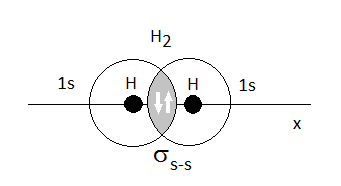
Enlace sigma en la molécula de H2, solapamiento frontal de dos orbitales s
Aquí vemos el modelo del enlace de valencia para la molécula de hidrógeno, H2. Se puede observar que se forma un enlace simple sigma, de solapamiento frontal (ambos orbitales atómicos sobre el eje x) entre los dos orbitales atómicos 1s de cada uno de los átomos de hidrógeno. Los electrones del enlace se aparean.
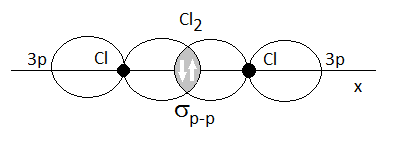
Enlace sigma en la molécula de Cl2, solapamiento frontal de dos orbitales p
Aquí vemos el modelo del enlace de valencia para la molécula de cloro, Cl2. El solapamiento se da de forma frontal entre los dos orbitales 3p de cada átomo de cloro, ambos con un electrón desapareado capaz de formar enlace covalente. Como se trata de un solapamiento frontal, sobre el mismo eje del enlace, es un enlace simple de tipo sigma entre dos orbitales p.
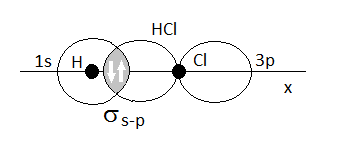
Enlace sigma en la molécula de HCl, solapamiento frontal de un orbital s y un p
Aquí vemos el modelo del enlace de valencia para la molécula de cloruro de hidrógeno, HCl. Se puede observar que se produce el solapamiento frontal (en el eje x, mismo eje del enlace) de dos orbitales semiocupados, con un único electrón, el 1s del hidrógeno y el 3p del cloro. La realidad es que el orbital 3p del cloro es de mucho mayor tamaño que el 1s, pero se ha representado así por razones de simplificación. El enlace formado es un enlace simple de tipo sigma s-p.
Enlace pi
En el enlace de tipo pi se produce un solapamiento lateral de dos orbitales p semiocupados (siempre p-p, es la única posibilidad en este caso) que se hallan en ejes paralelos entre sí y perpendiculares al eje del enlace. Para que se pueda dar un enlace pi debe haber previamente un enlace sigma, simple, entre los dos átomos que se enlazan. La interpenetración o solapamiento de los dos orbitales atómicos es menor que en el caso del solapamiento frontal, motivo por el cual el enlace pi es más débil y fácil de romper. Veremos en la explicación dos moléculas, una con enlace doble (1 sigma y 1 pi), la molécula de O2, y otra con enlace triple (1 sigma y 2 pi), de N2.
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente, Geometría molecular e hibridación y Modelo enlace de valencia.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Hola Profe! Muchas gracias por todos estos videos de enlaces!! super super geniales! ?tienes pensado poner algunos videos de ejercicios de enlaces? te lo agradeceriamos con el alma!! un beso grande!!
Sou, 12 Años Antes
¡Gracias! Me alegro mucho de que te gusten 🙂 Tengo que poner los ejercicios de enlace químico, pero de momento me va a ser imposible hasta dentro de algunas semanas ya que se me han acumulado muchísimas tareas, lo siento 🙁 De todas formas me podéis preguntar cualquier duda al respecto. Un abrazo.
QuimiTube, 12 Años Antes
Hola:
¿Que tal la tesina? espero que genial una duda Carmen ¿podrias decirme donde viene bien explicada la teoria de orbitales moleculares?
no la de hibridacion ni enlace de valencia
gracias y muchos ánimos 🙂
Marina, 12 Años Antes
Hola de nuevo 🙂 Ya te echaba de menos jeje
Pues el proyecto regular, muy agobiada, pero bueno, pronto se acabará el «calvario» jejeje
La teoría de orbitales moleculares no la tengo grabada (si no he consultado mal la legislación, en la mayoría de comunidades no se incluye en selectividad) y no sé recomendarte ninguna fuente… 🙁
QuimiTube, 12 Años Antes
Hola! Gracias Por los videos. Estoy recien iniciada en quimica y desde que encontre esta pagina ha sido mi salvacion…!! Como puedo diferenciar un enlace sigma entre orbitales sp y un enlace hibrido? Muchas Gracias!
Nikaly, 12 Años Antes
¡Hola Nikaly! Me alegro de que te sirvan 😀 Prácticamente siempre tendrás un enlace de tipo sigma por solapación frontal, aunque los orbitales que solapen sean híbridos. Es decir, el enlace entre un sp y un sp será sigma, o entre un sp3 y un sp, un sp3 y un s… Cualquier combinación que se te ocurre. El único tipo de enlace distinto es el pi, formado por solapamiento lateral de dos orbitales p sin hibridar. Si no tienes dos orbitales p paralelos, siempre tendrás un enlace de tipo sigma. Un saludo grande.
QuimiTube, 12 Años Antes
Muchas Gracias!! Ahora si lo entiendo…!
Nikaly, 12 Años Antes
Hola, me fascinan tus vídeos, son claros y concisos. Me has salvado ya de 2 parciales 😀 gracias. Seria de gran utilidad que informes en los correos o de alguna forma los vídeos nuevos para estar al tanto. Eres química pura?
NATALIA, 12 Años Antes
Hola Natalia, bienvenida. Me alegro mucho de que te sirvan y tu comentario me anima a continuar 🙂 Tenemos que poner alguna forma de suscripción para avisar del nuevo material que agregamos, pero todavía no ha sido posible por el gran volumen de trabajo que tenemos elaborando los vídeos. En todo caso te sugiero que te suscribas al Canal de Youtube y ahí te notificarán cuando agregemos material nuevo. Sí, soy química pura, en concreto ahora estoy haciendo el doctorado en el área de química física con reactividad molecular y fármacos. Un saludo grande.
QuimiTube, 12 Años Antes
hola gracias por los videos, empiezo en Agosto collegue y quiero ir preparandome, tu informacion a sido de mucha ayuda gracias saludos desde Denver, asi que preparate te voy a tener muchas preguntas…. 🙂
Ivan, 11 Años Antes
Hola Iván, bienvenido. Me alegro mucho de tenerte por aquí e intentaré responder tus dudas siempre que pueda 🙂 Ánimo con la preparación para el inicio de curso. Un saludo grande.
QuimiTube, 11 Años Antes
Hola, me gustaría saber si me podrías explicar como es lo de la Teoria del orbital molecular y como se construye el digrama. Por otra parte me gustaría saber que es una molecula paramagnética. Y gracias por el resto de videos, son muy buenos y me han ayudado mucho.
Tamara, 11 Años Antes
Hola Tamara, esto es contenido de nivel superior a bachillerato y por este motivo llegará más adelante. Un saludo grande y mil gracias por tus comentarios de apoyo, ayudan mucho a continuar.
QuimiTube, 11 Años Antes
se me ha olvidado decirte que estudio farmacia, y que el profesor de quimica no es que explique muy bien, por eso recurro a ti que con tus videos me has ayudado en muchas cosas 🙂
Tamara, 11 Años Antes
Hola Tamara, perdona la tardanza en responder. Me alegra que te sirva 🙂 Muchísima suerte con tus estudios y ánimo.
QuimiTube, 11 Años Antes
Muchisimas gracias por los videos sigue asi!gracias a gente como se consigue pasar los parciales de profesores que exigen sin explicar! ya podias ser mi profesora jaja! un saludo graacias guapa!
David, 11 Años Antes
¡Hola David! Muchas gracias por tu comentario 🙂 Me alegra mucho que te sirva el material. Soy tu profesora, aunque sea a distancia. Un saludo grande y ánimo con tus estudios.
QuimiTube, 11 Años Antes
Felicidades explicas muy bien! Podrias subir videos de termodinamica ??? 😀 Graciaaaas 🙂
Sofia, 10 Años Antes
¡Hola Sofía! Hay muchísimo de termodinámica, es un tema muy completo, aquí lo tienes: http://www.quimitube.com/videoscategory/termodinamica-quimica/
QuimiTube, 10 Años Antes
Hola, excelente explicación! . Una duda: En el caso del O2, este tiene un enlace sigma y uno pi. Es decir existe un solapamiento frontal de un orbital p con el otro p ( y tal como dijiste, este es el fundamento del enlace covalente, en donde hay compartición de electrones); sin embargo también hay un solapamiento lateral entre entre orbitales p, los cuales forman el enlace pi, sin embargo no veo un solapamiento debido a que los orbitales estan muy distanciados, como podría haber compartición de electrones entonces?
Cristian, 10 Años Antes
Hola…! Nesesito saber el estado natural del carbono porfa estoy en 10 grado de secundaria
Osiris, 9 Años Antes
En estado natural el carbono suele encontrarse como grafito o carbón. También puedes encontrar diamante, pero es termodinámicamente menos estable.
QuimiTube, 9 Años Antes
Hola!!
Muchas felicidades por la página, estoy preparándome selectividad gracias a tus videos. Las explicaciones son muy buenas!!! y hay infinidad de ejercicios.
Quería preguntar si vas a subir algo de formulación, recomiendas algún sitio para estudiarla desde 0??
muchas gracias por todo
mluisa, 9 Años Antes
¡Hola! ¡Muchas gracias! Aunque lo estamos remodelando por completo para que los vídeos no sean tan pesados y sean más amenos, tienes el curso de formulación inorgánica gratuito de StemByMe:
http://www.stembyme.com/web/formulacion-inorganica
Espero que te sirva aunque no hay orgánica.
Un saludo.
QuimiTube, 9 Años Antes
Hola, estoy en la uni y quería saber si tenías algún vídeo en el que explicases la teoría de orbitales moleculares?
Ricardo, 8 Años Antes
Hola Ricardo, lo siento, no lo tenemos por considerarlo precisamente contenido exclusivamente universitario. Un saludo.
QuimiTube, 8 Años Antes
ME ENCANTA! Contigo me saco la nota que quiero en selectividad fijo <3 Muchas gracias por lo que haces, es un gran trabajo.
Vanessa Maroto Juan, 8 Años Antes
Enhorabuena. Explicas muy bien
José, 5 Años Antes
Hola! Muchas gracias por la explicación, me ha servido de ayuda. Pregunto ¿Por qué, para que se forme el enlace pi, tiene que haber antes un enlace sigma?
Emmanuel, 4 Años Antes
¡Hola Emmanuel! Si te fijas, por geometría, para que dos orbitales p puedan formar un enlace pi, siempre vas a tener dos orbitales mucho más cercanos, que se enfrentan de una forma más intensa y frontal, que son los que forman el enlace sigma. Yo diría de una forma un tanto coloquial que el enlace sigma no lo podemos evitar.
QuimiTube, 4 Años Antes