Valoración de ácidos polipróticos
Escrito por Quimitube el 8 septiembre
Hemos tratado tanto en la teoría de los equilibrios ácido base como en la resolución de los ejercicios, que la reacción de neutralización ácido base se puede emplear en el laboratorio para realizar un procedimiento analítico, denominado valoración o volumetría ácido base, que permite conocer la concentración de una disolución de ácido o de base de concentración desconocida.
En este contexto hemos visto algunas sencillas, como la valoración de un ácido fuerte, el ácido clorhídrico, HCl, con una base fuerte, el hidróxido sódico, NaOH; también hemos hablado del caso de una valoración de ácido débil, el ácido acético, CH3COOH, con una base fuerte. Tanto el ácido clorhídrico como el ácido acético son ácidos monopróticos, esto es, tienen un único protón. La reacción de neutralización para estos ácidos será, por tanto:
HCl + NaOH –> (Na+, Cl-) + H2O
CH3COOH + NaOH –> (Na+, CH3COO-) + H2O
Sin embargo, también se puede determinar por valoración ácido base un ácido poliprótico, es decir, que tenga más de un protón. Éste es el caso del ácido sulfúrico, H2SO4 (diprótico), o del ácido fosfórico, H3PO4 (triprótico). ¿Qué diferencia hallamos? Bueno, la valoración de un ácido monoprótico presenta un único salto. En cambio, la valoración de un ácido diprótico presenta dos saltos bien definidos, y la valoración de un ácido triprótico, tres, siempre y cuando las constantes de disociación de cada equilibrio químico estén bien separadas.
Debemos tener en cuenta que, en el caso de ácidos polipróticos con los valores de sus constantes bien separadas, los distintos protones se valorarán de forma secuencial; el primero siempre es más ácido que el segundo (cuesta menos perder el primero que el segundo). Por ejemplo, supongamos que valoramos ácido oxálico, HOOC-COOH, con NaOH. Tendremos, por tanto:
Valoración del primer protón del ácido oxálico:
HOOC-COOH + NaOH –> (HOOC-COO- ,Na+) + H2O
Valoración del segundo protón del ácido oxálico (una vez valorado el primero por completo):
HOOC-COO- + NaOH –> (Na+, -OOC-COO-) + H2O
Esta curva tendrá la apariencia siguiente,
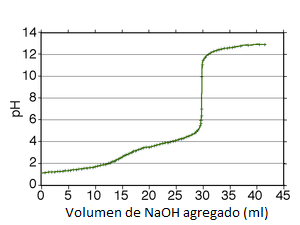
- Curva de valoración del ácido oxálico
Como se puede ver se observan dos saltos, el primero menos pronunciado que el segundo pero ambos fácilmente observables.
Por tanto, si queremos calcular la concentración de ácido oxálico, tendremos que tener en cuenta que durante la valoración se consumirá, lógicamente, el doble de volumen de base que en la valoración de un ácido monoprótico, y que debemos elegir un indicador adecuado, que vire en la valoración del segundo protón.





Información Bitacoras.com…
Valora en Bitacoras.com: Hemos tratado tanto en la teoría de los equilibrios ácido base como en la resolución de los ejercicios, que la reacción de neutralización ácido base se puede emplear en el laboratorio para realizar un procedimiento analítico,…..
Bitacoras.com, 12 Años Antes
HOLA quisiera conocer los calculos realizados para la valoracion de acido oxalico con hidroxido de sodio, ya que necesito encontrar el pH a diferentes volumenes.
GRACIAS.
pablo larios, 11 Años Antes
¡Hola! Podrías hacerlo de forma sencilla con la fórmula V1·N1 = V2·N2, siendo V1 el volumen de ácido y N1 su normalidad, y V2 el volumen de base y N2 su normalidad. Tendrás que tener en cuenta para la normalidad del ácido que 1 mol de ácido oxálico son 2 equivalentes gramo.
QuimiTube, 11 Años Antes
si tuviéramos un problema de titulación de ácido poliprótico en el que nos dieran la concentración del ácido y la base. Cómo sacaríamos teóricamente el pH de la solución? GRACIAS.
América, 11 Años Antes
¡Hola! Tendríamos que plantear los distintos equilibrios y hacer uso de los valores de pK para cada uno de ellos, pero no te puedo recomendar ningún vídeo al respecto porque eso sería de nivel universitario y nosotros sólo tenemos nivel preuniversitario, lo lamento.
QuimiTube, 11 Años Antes