El ozono o a qué huelen las tormentas
Escrito por Quimitube el 6 julio
¿Alguna vez has notado, después de una tormenta eléctrica, que el aire huele distinto? ¿Un olor picante, quizá, característico de esos chaparrones con relámpagos? Probablemente, ese olor distinto que has sentido en el aire sea el del ozono.
El ozono es una forma alotrópica del oxígeno (ya comentamos en la última entrada acerca de los fulerenos que la alotropía es la propiedad que poseen algunos elementos químicos de presentarse en la naturaleza bajo estructuras químicas distintas). Se trata de un gas formado por tres átomos de oxígeno, O3(g), es decir, es un compuesto triatómico, y se puede formar cuando una descarga eléctrica muy intensa pasa a través del oxígeno gaseoso, O2 (de ahí que se forme en las tormentas). También se forma cuando el oxígeno diatómico es irradiado con luz ultravioleta intensa, y esto es lo que pasa esencialmente en la estratosfera, que es donde se concentra la mayor parte del ozono atmosférico.
Todos hemos oído hablar de la capa de ozono (o quizá en mayor medida del agujero de la capa de ozono). Pues bien. Esta capa formada en la estratosfera es capaz de absorber las radiaciones ultravioleta, impidiendo que lleguen a la superficie de la Tierra. Se puede afirmar, sin titubeos, que el ozono es uno de esos compuestos químicos que está en la lista de «compuestos químicos de nuestro entorno a los que les debemos la vida».

Se puede observar, en color azul, el agujero de la capa de ozono el 22 de septiembre del 2004.
No obstante, esto no quiere decir que no sea peligroso para la salud humana. En las alturas nos protege, pero en contacto con nosotros no es muy recomendable (irrita los ojos y las vías respiratorias a concentraciones a partir de 0,05 ppm y puede resultar mortal). Aquí vemos los pictogramas de seguridad del ozono:

Aquí vemos los pictogramas que deben aparecer en el etiquetado de un recipiente que contenga ozono.
Aquí tienes un enlace a la ficha de datos de seguridad del ozono
El ozono como tal es un compuesto tóxico y explosivo. Se trata de un gas inestable, de color azul, que es sumamente oxidante. Tanto, que puede oxidar todos los metales comunes excepto el platino y el oro, y de entre todos los oxidantes habituales sólo le supera el flúor (potencial estándar de reducción del par F2/F(-) de 2,87V).
Por este motivo se utiliza en algunas EDAR (Estaciones Depuradoras de Aguas Residuales) o ETAP (Estaciones de Tratamiento de Agua Potable) para eliminar bacterias de los efluentes de salida (aguas tratadas o aguas potables) porque presenta la ventaja frente a otro oxidante común, el cloro, de no dejar ni sabor ni olor residual en el agua.
La geometría de la molécula de ozono es angular:
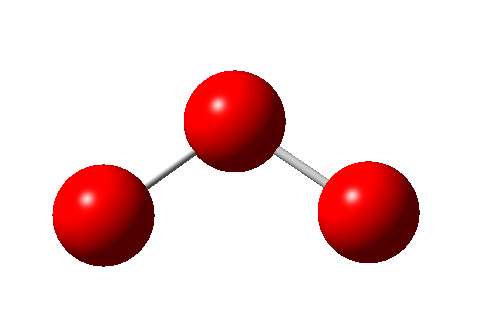
Se puede observar la geometría de la molécula de ozono, formada por tres átomos de oxígeno. Su ángulo de enlace es de 116,8º y la distancia de enlace de 1,278A.
La distancia de enlace O-O de 1,278A es un valor intermedio entre el enlace sencillo (1,320A) y el doble (1,207A), dado que se han de considerar dos estructuras de resonancia que hacen que el enlace tenga este valor:
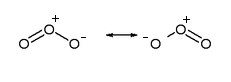
Se pueden ver las dos formas resonantes de la molécula de ozono, que hacen que la distancia de enlace final sea intermedia entre el enlace simple y el doble.
El ozono condensa a -111,9 ºC, el líquido es de color azul intenso y solidifica a -192,5ºC, dando un sólido de color violeta oscuro. Ambos son explosivos, ya que se descomponen para dar oxígeno diatómico desprendiendo gran cantidad de energía, es decir, se trata de una reacción fuertemente exotérmica:
2O3(g) –> 3O2(g)
La variación de entalpía de esta reacción es de -284 kJ.
Así que ya sabes. Si después de una tormenta notas en el aire un olor distinto, acuérdate de nuestro amigo ozono, pero tampoco lo respires demasiado, que es un amigo un poquito traicionero y cuanto más lejos, mejor (así como por ejemplo en la estratosfera, estará perfecto).




