La reacción redox implicada en el funcionamiento de una pila alcalina
Escrito por Quimitube el 23 abril
Las pilas alcalinas, o también llamadas de tipo Mallory, son probablemente las más utilizadas en la actualidad, a pesar de que están siendo desplazadas en muchos aparatos electrónicos (teléfonos móviles, cámaras, reproductores de música y vídeo…) por las baterías recargables. ¿Quién no recuerda al conejito de Duracell y al consabido eslogan «y duran, y duran, y duran…»?
Pues bien, una pila alcalina se fundamenta en la reacción de oxidación reducción que se da entre el zinc metálico y el dióxido de manganeso en medio básico (de ahí el nombre de «alcalina»). Como electrolito contiene hidróxido de potasio, KOH, que es el que aporta el medio básico requerido por la reacción y cuya migración evita la polarización de la pila (recuerda que era necesario un electrolito dentro del puente salino para el funcionamiento de cualquier celda electroquímica).
En el ánodo, es decir, en el electrodo de polaridad negativa, se produce la oxidación del Zn pulverizado, mientras que en el cátodo, es decir, en el electrodo de polaridad positiva, se produce la reducción del óxido de manganeso (IV), MnO2, (que actúa como oxidante) para dar óxido de manganeso (III), Mn2O3. Las semirreacciones que se producen son las siguientes:
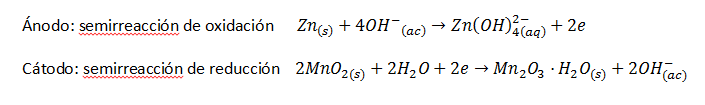
Como ves, son unas semirreacciones más complicadas que las que hemos visto en el ajuste de reacciones de oxidación-reducción del temario. Ni siquiera las semirreacciones indicadas describen por completo el proceso real, son una simplificación del mismo, que transcurre en varias etapas con formación de distintos compuestos intermedios. Además, las semirreacciones no transcurren, como hemos visto, en disolución. En una pila alcalina, el ánodo está formado por zinc pulverizado, y el cátodo es una barra de acero rodeada de una pasta espesa y negruzca de MnO2, KOH y agua.
Se producen multitud de reacciones paralelas en función de las condiciones del entorno. Por ejemplo, la reacción de producción de hidrógeno. ¿Has visto alguna vez una pila alcalina hinchada como un globo, como a punto de explotar? Se debe a la siguiente reacción secundaria:
![]()
Que produce hidrógeno gaseoso y la hace hincharse.
El proceso global de una pila alcalina se puede escribir como:
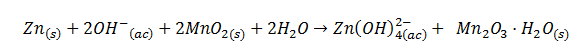
Aquí tienes una fotografía donde se muestran el ánodo (la carcasa exterior) y el cátodo (el cilindro central):

Fuente: wikipedia, pila alcalina
Una pila alcalina basada en esta reacción Zn/MnO2 en medio básico tiene una fuerza electromotriz o potencial estándar de 1,5V, y su «buena fama» con respecto a otras pilas no alcalinas (como la pila tipo Leclanché o pila salina) se debe a que conserva esta fem estable durante más tiempo. Por algo hemos dicho antes que «duran, y duran, y duran…»
No obstante, cuando las pilas alcalinas dejan de durar y tengas que deshacerte de ellas, recuerda que no se deben desechar en la basura doméstica, sino en puntos verdes habilitados al efecto o, incluso, en los mismos establecimientos donde las adquiriste. ¡Más cómodo imposible!
Quizá también te interese:
Fabricación de hipoclorito sódico con una pila y agua con sal
Fabricacion de una pila Daniell con un limón
Explicación detallada de la pila Daniell (en vídeo)





[…] La reacción redox implicada en el funcionamiento de una pila alcalina […]
La oxidación del hierro: formación de óxido férrico, herrumbre | Quimitube, 12 Años Antes
el catodo es el electrodo con carga negativa y se da el proceso de reduccion y anodo carga positiva proceso de oxidacion gracias
GUILLERMO CRUZ, 11 Años Antes
Hola Guillermo, ignoro si hay algún otro criterio a nivel americano, pero según el establecido más habitual (al menos en los textos académicos españoles) se considera cátodo al electrodo de reducción y el ánodo el de oxidación.
QuimiTube, 11 Años Antes
[…] http://aprenderpilaalcalina.blogspot.com.es/ http://www.quimitube.com/reaccion-redox-funcionamiento-pila-alcalina/ […]
Tipos de pilas. Pilas Alcalinas. | magda96quimica, 11 Años Antes
genial
nicole, 9 Años Antes