La energía de activación y las tormentas
Escrito por Quimitube el 21 febrero
A lo largo del tema de cinética química hemos hablado de la energía de activación de una reacción. En concreto, la hemos definido desde dos perspectivas distintas, la teoría de colisiones y la teoría del estado de transición (aunque no debemos olvidar que se trata, en todo caso, de la misma energía). Así:
– Según la teoría de colisiones, la energía de activación es la energía cinética necesaria para que un choque sea efectivo y se rompan los enlaces de los reactivos.
– Según la teoría del estado de transición, la energía de activación es la energía necesaria para que se forme el complejo activado.
Cuanto mayor es la energía de activación, por tanto, más difícil es de alcanzar, y esta barrera hace que haya reacciones química que, a pesar de ser termodinámicamente favorables (es decir, tener una variación de energía libre de Gibbs negativa) no se produzcan en determinadas condiciones o son extremadamente lentas. Del mismo modo, una reacción termodinámicamente desfavorable pero con una energía de activación pequeña sí puede transcurrir de forma apreciable en ambos sentidos. Empleando el símil de la montaña, cuanto más alta es la cima más cuesta llegar hasta ella. Recordemos que el diagrama energético de las reacciones endotérmicas y exotérmicas es el siguiente:
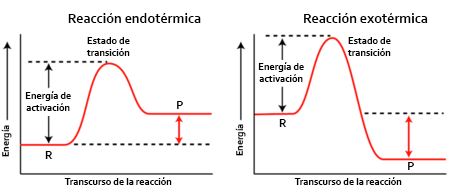
Sin embargo, que una reacción química tenga una energía de activación muy alta no significa que sea imposible, sino que necesitará unas determinadas condiciones para producirse, como por ejemplo una chispa, una llama o un golpe fuerte (pensad, por ejemplo, en la nitroglicerina, que puede estallar por una agitación del recipiente que la contiene). Y dentro de estas especiales condiciones hallamos los rayos de una tormenta eléctrica.

Rayos de una tormenta descargando desde la nube hasta la Tierra. Se puede observar la gran cantidad de energía,
lo que hace que en el entorno de estos rayos se puedan producir reacciones químicas que de otro modo no se producirían. Imagen de John R. Southern, Flickr. Licencia CC By-SA 2.0
Los rayos de una tormenta eléctrica descargan como media 500 megajulios de energía (5·108 julios, una barbaridad), y el aire circundante puede alcanzar temperaturas de hasta 20.000 ºC [1]. Con semejantes condiciones, es normal que más de una reacción química pueda alcanzar la energía de activación suficiente y producirse en la atmósfera, a pesar de que no sea posible en nuestras condiciones habituales. Veamos el siguiente vídeo de edu2000.org:
En este vídeo se explica que para que se produzca reacción entre el metano, CH4, y el oxígeno atmosférico, O2, se necesita la energía de una llama para alcanzar la energía de activación suficiente (una vez iniciada, el propio calor liberado ayuda a que la reacción se siga produciendo y de hecho, la reacción puede ser incluso explosiva), mientras que otras reacciones químicas, como la combinación del oxígeno y el nitrógeno diatómicos para producir monóxido de nitrógeno, necesitan de la inmensa energía de un rayo para producirse. Es decir:
N2(g) + O2(g) → 2NO(g)
Es decir, en las capas altas de la atmósfera y en zonas más bajas durante las tormentas, se puede producir el monóxido de nitrógeno. Sabemos que esto no ocurre de forma habitual porque el aire está compuesto en un 79% de nitrógeno y en un 21% de oxígeno, y sin embargo permanecen estables, sin reaccionar entre sí, gracias a lo que nosotros podemos respirar con normalidad. De lo contrario, el oxígeno se convertiría por completo en NO… De modo que debemos dar gracias a la energía de activación que nos permite vivir en un planeta con una estupenda atmósfera de oxígeno. ¡Gracias Ea!
[1] https://str.llnl.gov/str/pdfs/05_96.1.pdf





excelente!!
belen, 9 Años Antes
¡Muchas gracias!
QuimiTube, 9 Años Antes
que significa que la energia de activacion sea pequeña
soy nueva, 9 Años Antes
Significa que es fácil de alcanzar (una cima de la montaña pequeña) y por tanto la reacción es rápida (es más rápido subir una montaña bajita que una montaña alta, recuérdalo así). Un saludo.
QuimiTube, 8 Años Antes