¿Cómo se determina el contenido de ácido en un vino?
Escrito por Quimitube el 3 noviembre
¿Qué es el vino?
Está bien, lo admito, esta pregunta puede parecer de respuesta bastante obvia. El vino es esa bebida tan consumida, que tanto gusta en bodas, bodorrios y celebraciones varias sí, pero… la pregunta que nos hacemos aquí es, más bien, ¿qué es el vino químicamente hablando? Poco nos importan su patrones de consumo y su precio cuando lo que queremos es tratarlo como una muestra analítica para determinar su contenido ácido. Así, podemos decir que el vino es, como el vinagre, una disolución acuosa. Procede de la fermentación alcohólica del zumo de uva por la acción de determinadas levaduras (del género Saccharomyces), que transforman los azúcares principalmente en etanol y dióxido de carbono.
![]()
En este caso la disolución está formada por algunos azúcares residuales que no se han transformado con la fermentación, así como etanol y otras sustancias procedentes de la uva, como por ejemplo los taninos, que actúan como antioxidantes naturales, compuestos fenólicos y algunos aditivos (agentes antioxidantes y antimicrobianos principalmente). Además contiene disueltos algunos ácidos, siendo el ácido más habitual de su composición uno más complejo que el acético, el tartárico, que presenta dos grupos funcionales ácidos, -COOH. Su fórmula completa es
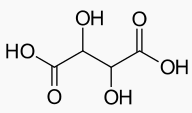

Un vino es una disolución acuosa que contiene distintas cosas, entre ellas en torno a un 12% de etanol producido por fermentación de los azúcares de la uva
Concentración de ácido tartárico de un vino: cómo determinarla en el laboratorio
En una entrada anterior vimos cómo determinar el contenido ácido de un vinagre. En el vinagre, como la concentración ácida es considerable, se debía realizar una dilución previa al análisis químico en el laboratorio. En el caso de los vinos, en cambio, como la concentración ácida es bastante inferior a la del vinagre, no es necesario realizar una dilución previa en matraz, por lo que se pueden introducir directamente 50 ml de la muestra en el erlenmeyer. Sin embargo sí que podemos añadir posteriormente agua destilada (otros 50 mL, aunque esto será aproximado porque los cálculos se efectuarán en base al volumen de muestra inicial, y no al volumen de disolución total en el erlenmeyer). Esto lo hacemos para que sea más fácil detectar el punto final de la valoración con fenolftaleína; de lo contrario, el color del vino, si es un vino tinto o rosado, podría enmascararlo. De hecho podemos añadir más agua si consideramos que 50 mL no son suficientes para detectar correctamente el punto final. Una vez preparada la muestra a analizar, del mismo modo que en el caso del vinagre, realizaremos una valoración base fuerte – ácido débil, en la que utilizaremos NaOH poco concentrado en la bureta como valorante, aunque conviene poner más fenolftaleína que en el caso del vinagre para que el cambio de color sea más intenso y detectable.
La concentración ácida de la muestra se expresará como como porcentaje (peso/volumen) de ácido tartárico, C2H4O2(COOH)2 (cuya masa molecular es de 150,09 g/mol). Hay que tener en cuenta que el ácido tartárico es diprótico, es decir, tiene dos hidrógenos ácidos, y que ambos son neutralizados, es decir:
![]()
Para que veáis un ejemplo más claro, supongamos que hemos analizado 50 mL de un vino con hidróxido sódico 0,1M y que hemos gastado un volumen de 45 mL. Los cálculos que tendremos que realizar para determinar el porcentaje peso/volumen de ácido en dicho vino serán:
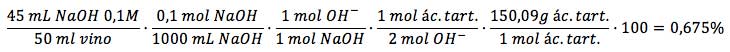
Aunque la muestra puede contener otros ácidos además del tartárico (por ejemplo el ácido málico también está muy presente), lo habitual es expresar el contenido ácido de este modo, como si todo el ácido presente fuese tartárico, por cuestiones prácticas. Generalmente, los vinos suelen tener poco menos del 1% de ácido (peso/volumen) expresado como ácido tartárico. El porcentaje de peso/volumen también nos permite determinar la molaridad del ácido y, a partir de ahí y conociendo su constante de acidez, podríamos determinar también el pH del vino, tal y como se realiza en este ejercicio resuelto de ácido base.
Como podéis ver se trata de una práctica que se puede llevar a cabo sin muchos problemas con un instrumental de laboratorio básico para la realización de neutralizaciones ácido-base, por lo que es bastante adecuada para el aprendizaje escolar de esta metodología de análisis y también para practicar los cálculos estequiométricos y el cálculo del pH de una disolución de ácido débil, cuyo valor se podría comparar con el obtenido en el laboratorio mediante el uso de un pHmetro. Además, el hecho de utilizar como muestra analítica algo que forma parte de la vida cotidiana puede ser más interesante que analizar, por ejemplo, una disolución de ácido clorhídrico preparada cuya utilidad no es observada por los alumnos de un modo tan inmediato.
Fuentes e información adicional:
SKOOG, Douglas. WEST, Donald M. HOLLER, F. James. CROUCH, Stanley R. Química Analítica. 7a ed. México: McGrawHill, 2001. ISBN: 970-10-3358-2.
MONGAY, Carles. CERDÀ, Víctor. Fundamentos de Química Analítica. UIB, 1998. ISBN: 84-7632-384-0.





[…] Para determinar el contenido ácido de un vino es necesario realizar una valoración ácido base con hidróxido sódico y fenolftaleína. […]
Determinar el contenido ácido de un vino..., 10 Años Antes