¿Qué es la dureza del agua y cómo se determina en el laboratorio?
Escrito por Quimitube el 29 enero
La dureza del agua es uno de los parámetros químicos más importantes a la hora de calificar la calidad de un agua. El Real Decreto 140/2003, de 7 de febrero, por el que se establecen los criterios sanitarios de la calidad del agua de consumo humano, no establece ningún límite para la dureza en su Anexo I. Parámetros y valores paramétricos, aunque sí establece algunos relacionados de forma indirecta, como la conductividad o incluso el sabor. El motivo es que el agua se puede beber con durezas elevadas [1] y la norma no establece, por ello, qué valor debe presentar el agua que sale de nuestros grifos.
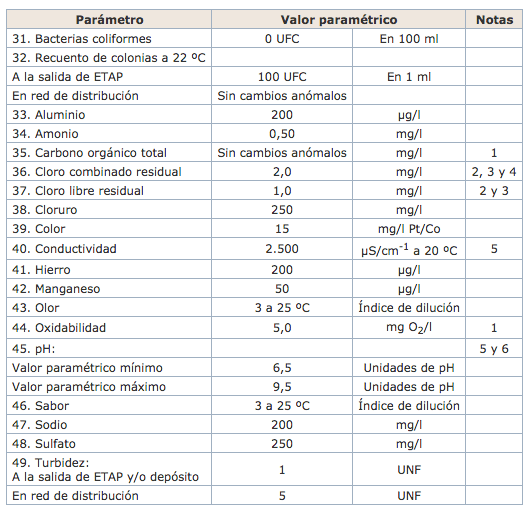
Anexo I, parte C, del Real Decreto 140/2003. Parámetros indicadores.
Sin embargo, que no aparezca limitada la dureza en el agua potable de la red no significa que no tenga consecuencias en multitud de procesos cotidianos, como su uso para el lavado personal o de la colada. Por ejemplo, en la caracterización de la calidad de un agua de riego sí que se tiene muy en cuenta el valor de este parámetro porque dependiendo del tipo de suelo puede ser positivo o negativo.
¿Qué es la dureza del agua y en qué unidades se mide?
La dureza del agua se puede definir como la concentración total de iones calcio y de iones magnesio (Ca2+ y Mg2+), los dos cationes divalentes más habituales en un agua natural; en realidad, podríamos definir la dureza como la suma de todos los cationes polivalentes, pero son con mucha diferencia calcio y magnesio los que tienen importancia en la dureza global de un agua. Así, podríamos escribir, simplemente:
Dureza (M) = [Ca2+] + [Mg2+]
Sin embargo, es muy frecuente que esta dureza se determine o se indique como masa de carbonato cálcico en miligramos por cada litro de disolución, es decir, mg CaCO3/L. ¿Significa esto que todo el calcio presente en un agua dura proviene de carbonato cálcico? No, solo que, por convenio, suele tratarse como si así fuera; es más, se considera como si todo el calcio estuviese en forma de carbonato cálcio y el magnesio también fuese carbonato cálcico. Así, existe otra fórmula que permite indicar la dureza en mg/L de CaCO3 conociendo las concentraciones en mg/L de Ca2+ y de Mg2+, que es la siguiente:
Dureza (mg/L) CaCO3 = 2,50 [Ca2+] + 4,16 [Mg2+]
Los coeficientes indicados se deben a la relación existente entre la masa del calcio y del magnesio con la masa del carbonato cálcico (100/40 para el calcio, 100/24 para el magnesio).
Dividiendo por 10 esta misma relación, tenemos otra unidad frecuentemente utilizada, los llamados GHF o ºfH (Grados Hidrotimétricos Franceses); también existen otras unidades, como los grados ingleses, los americanos o los alemanes, pero mucho menos extendidos que los franceses. Estos últimos dan lugar a la escala de clasificación de un agua muy dulce a un agua muy dura:
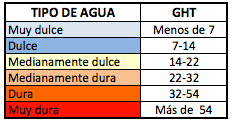
Como vemos, un agua muy dulce (o muy blanda) es aquella que presenta una dureza inferior a 7ºfH (o a 70 mg de CaCO3/L), mientras que un agua muy dura es aquella que presenta más de 54ºfH (más de 540 mg CaCO3/L). En España tenemos una variación muy grande de la dureza de las aguas de suministro, desde provincias como Segovia o Madrid, con unos valores en torno a 5ºfH, hasta otras como Almería o Ciudad Real, donde se pueden alcanzar los 60.
Efectos negativos del agua dura
La presencia de bicarbonatos en el agua hace que, cuando se calienta el agua dura, se formen precipitados de carbonato cálcico que dan lugar a las llamadas costras calcáreas, según la reacción siguiente:
Ca2+ (aq) + 2HCO3– (aq) ↔ CaCO3(s) + CO2(g) + H2O(l) (Reacción 1)
Este carbonato cálcico lo conocemos muy a menudo como cal en el lenguaje coloquial (pensad, por ejemplo, en los productos de limpieza que prometen acabar con los restos de cal en lavabos o mamparas de ducha, aunque normalmente los mismos son consecuencia más bien de la reacción del calcio con el jabón). Pero no es solo un problema de limpieza, sino que si se produce el depósito sólido en entornos industriales, puede llevar a la ocurrencia de costosas averías en calderas, torres de enfriamiento y otros equipos. Estas costras calcáreas se pueden eliminar provocando la reacción química inversa a la anterior, es decir, que forme nuevamente calcio soluble y bicarbonato. Esto se puede lograr, por ejemplo, añadiendo un exceso de dióxido de carbono o un ácido débil, como ácido acético (vinagre) o ácido cítrico (zumo de limón). Muchos preparados de limpieza para eliminar la cal se basan, de hecho, en un pH ligeramente ácido.

Acumulación de carbonato cálcico en el interior de una tubería. «TuberiaCalcio» by Josefus2003 – Own work. Licensed under CC BY 3.0 via Wikimedia Commons.
En el ámbito doméstico, el agua dura causa también efectos indeseables como la acumulación en calderas, cafeteras, conductos de agua y calentadores, y hace que sea necesario utilizar una mayor cantidad de jabón y de detergente, aunque el motivo sea distinto. En el caso de los jabones, que son carboxilatos de metales alcalinos procedentes de ácidos grasos, con largas cadenas carbonadas, el calcio reacciona directamente con el jabón formando grumos insolubles según la reacción genérica siguiente [3]:
Ca2+ + 2RCO2 → Ca(RCO2)2(s)
Para el caso, por ejemplo, del estearato sódico, un componente frecuente en muchos jabones, tendríamos:
2 C17H35COO− (aq) + Ca2+ (aq) → (C17H35COO)2Ca (s)
Lo que hace que se destruyan las propiedades surfactantes del jabón y su capacidad para formar espumas y puede causar, por ejemplo, que necesitemos mayor cantidad de champú o de gel para conseguir la misma espuma si vivimos en una región de agua dura.
En el caso de los detergentes, a diferencia de los jabones, no hay una reacción directa del calcio ni del magnesio con los mismos, pero sí una interferencia que hace deseables las aguas blandas para, por ejemplo, lavar la ropa. Cuanto más dura es un agua mayor es la cantidad de detergente que gastaremos en cada lavado. Como ejemplo, ved la siguiente imagen, procedente de un producto para la colada, que indica la cantidad de detergente a usar en función de la dureza del agua de la región en la que vivimos, siendo mucho más elevada en el caso de agua dura:
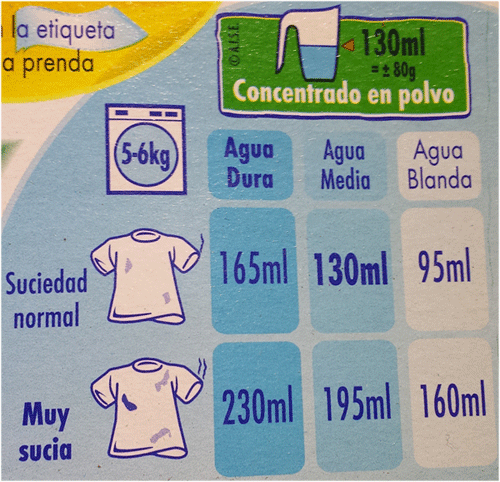

Ejemplo del envase de un detergente donde se puede observar que se recomiendo utilizar más cantidad en aquellas aguas con elevada dureza. Asimismo, también se muestra un mapa con la dureza aproximada de cada zona de España.
A causa de todos estos efectos negativos, es muy deseable eliminar parte de la dureza de un agua dura antes de usarla.
Cómo eliminar la dureza del agua: los descalcificadores
Para eliminar la dureza del agua se puede recurrir a distintos métodos; el más básico es la eliminación de la dureza del agua por calentamiento. La dureza de un agua solo se podrá eliminar por calentamiento si se trata de la denominada dureza temporal, es decir, si se encuentra en forma de bicarbonato cálcico. En ese caso, calentar el agua hace que se produzca la Reacción 1 y que precipite el carbonato cálcico, reduciendo la dureza global del agua. Si el calcio procede de otras sales, como cloruro cálcico (CaCl2) o sulfato cálcio (CaSO4) no se elimina por calentamiento y recibe el nombre de dureza permanente.
El calentamiento, sin embargo, no es práctico ya que es, precisamente, el que hace que la cal se acumule en conductos y calentadores de agua (hemos dicho ya que el agua caliente hace que precipite la cal en ellos formando costras calcáreas) y, además, calentar el agua una vez que ya ha pasado a través de estos conductos ni nos es útil ni es viable en un uso doméstico. Por ello, cuando lo que se quiere es que el agua que sale de nuestros grifos o la que va a nuestro calentador tenga una dureza inferior a la que viene del suministro externo, es necesario utilizar otros métodos de descalcificación.
Descalcificación por adición de productos químicos
La dureza se puede eliminar mediante el uso de reacciones químicas, como la adición de carbonatos de un metal alcalino (sodio o potasio) o cal (hidróxido de calcio) que provocan la precipitación del calcio como carbonato cálcico y del magnesio como hidróxido, o también la adición de hidróxido de calcio, que produce la siguiente reacción:
Ca2+ + 2HCO3– + Ca(OH)2 → 2CaCO3(s) + 2H2O
Mientras que, en dureza permanente, sin bicarbonato en el medio, se puede utilizar carbonato sódico, que aporta carbonato adicional y aumenta mucho el pH del medio, lo cual favorece la precipitación:
Ca2+ + 2Cl– + 2Na+ + CO32- → CaCO3(s) + 2Cl– + 2Na+
También se puede precipitar eficazmente el calcio por adición de un ortofosfato en medio básico:
5Ca2+ + 3PO43- + OH– → Ca5OH(PO4)3(s)
Estos métodos son principalmente utilizados a nivel industrial, pero raramente a nivel doméstico.
En los hogares, lo que se suele utilizar para descalcificar el agua de suministro es un aparato descalcificador o ablandador de agua, que es un aparato que por distintos medios es capaz de disminuir la dureza: métodos mecánicos (ósmosis inversa) o medios químicos (intercambio iónico). Aunque existen en el mercado otros métodos, como los llamados catalíticos o los electrónicos, no hay evidencia clara de su eficacia, de modo que nos centraremos únicamente en los dos que sí que han demostrado su utilidad sobradamente.
Descalcificación por ósmosis
Los descalcificadores de ósmosis inversa funcionan haciendo pasar el agua a través de una membrana semipermeable por aplicación de altas presiones. El agua atraviesa la membrana dejando atrás todas las partículas minerales (incluyendo calcio y magnesio) y otras impurezas. La presión viene determinada por la resistencia de las membranas utilizadas. Se trata de equipos relativamente sencillos diseñados para purificar el agua del grifo y que mejore su calidad para beber o en otros usos domésticos. Sin embargo, la constante limpieza de las membranas y el bajo caudal de agua que pueden producir los equipos pequeños hace que no se descalcifique el suministro total de una vivienda sino solo una parte (por ejemplo, el grifo de la cocina).
Descalcificación con resinas de intercambio catiónico
Otro proceso para la eliminación de la dureza del agua es la descalcificación mediante el uso de resinas de intercambio catiónico. Lo más habitual es utilizar resinas de intercambio catiónico que intercambian calcio y magnesio por otros iones monovalentes, como H+, K+ o Na+, generalmente estos dos últimos (que no acidifican el agua, a diferencia de H+). Ni el sodio ni el potasio producen problemas de precipitación de sólidos ni de reacción con los jabones, por lo que es un método muy adecuado. Generalmente, se trata de equipos descalcificadores que llevan unos cartuchos con un tiempo de vida útil dado; cada cartucho dejará de servir cuando haya intercambiado todos sus cationes monovalentes por calcios y magnesio, momento en el que tendrá que ser reemplazado porque ya no realizará su función de ablandamiento de agua.
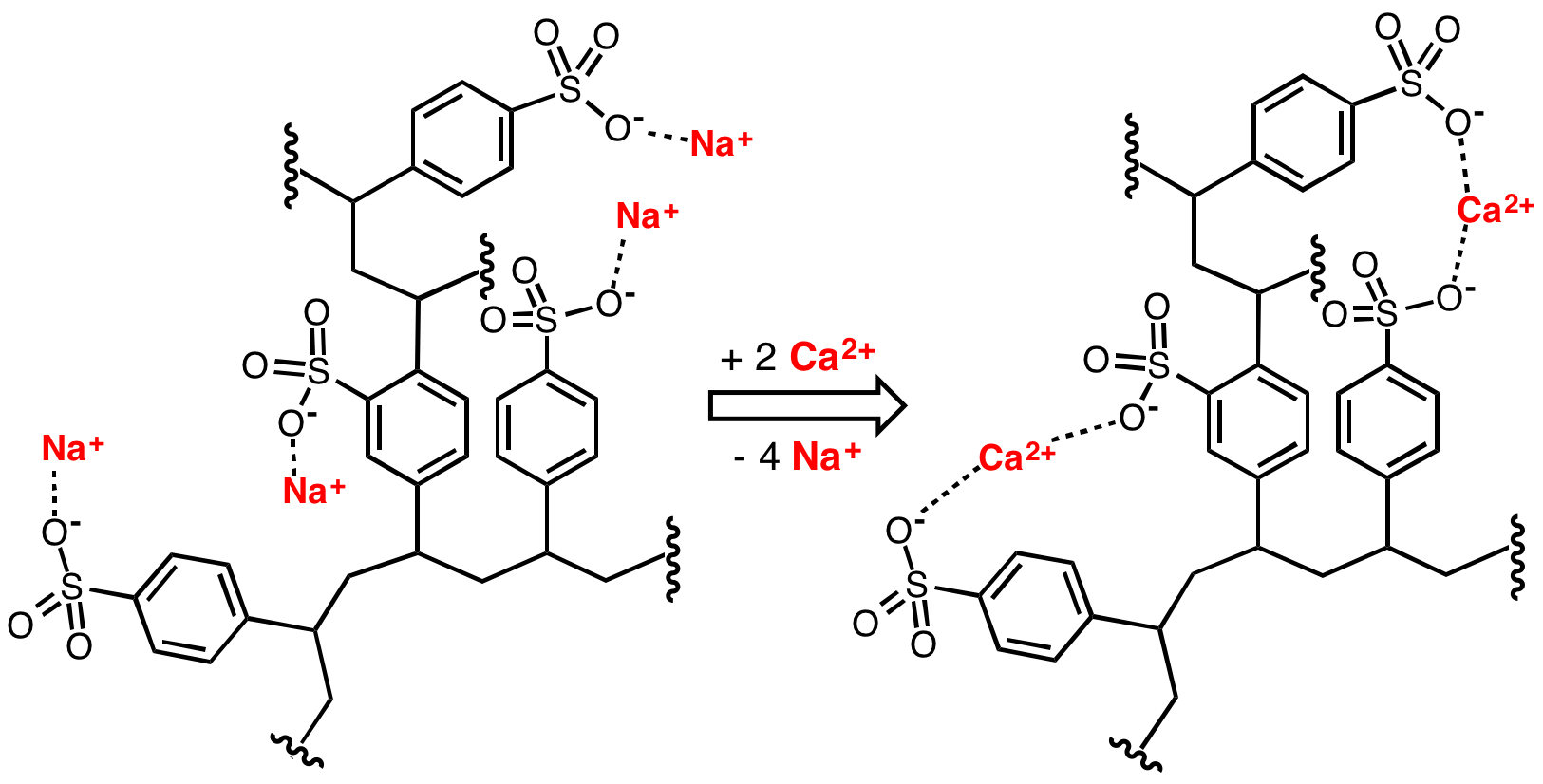
Ejemplo del proceso de intercambio iónico en una resina intercambiadora de cationes tipo. Vemos que los Na+ se desunen y se unen los Ca2+. «CationExchCartoon» by Smokefoot – Own work. Licensed under CC BY-SA 3.0 via Wikimedia Commons.
Las resinas de intercambio iónico se encuentran en forma de perlas pequeñas que se empaquetan en el interior del cartucho. El agua dura pasa por entre las perlas y el intercambio catiónico se lleva a cabo en la superficie:

Ejemplo de las perlas de una resina de intercambio iónico.
A continuación vemos un ejemplo de este tipo de equipos descalcificadores de filtros de intercambio catiónico:
¿Cómo se determina la dureza del agua en el laboratorio?
Para determinar la dureza de un agua en el laboratorio, un método utilizado muy frecuentemente es la titulación complejométrica con EDTA (ácido etilendiaminotetraacético). Es un reactivo que tiene aplicación en la determinación de un gran número de cationes metálicos a excepción de los metales alcalinos; esto podría hacer pensar que es poco selectivo, pero el control de las condiciones del medio y el uso de indicadores adecuados puede solventar este problema. Por ejemplo, los cationes trivalentes se pueden determinar sin que los cationes divalentes interfieran si se realiza la valoración con un pH cercano a 1. Esta es la estructura química de este compuesto:
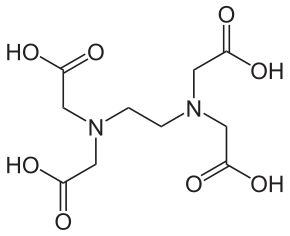
EDTA o H4Y. Presenta cuatro grupos carboxílicos, -COOH, por lo que se puede desprotonar para dar la especie con cuatro cargas negativas que simbolizamos como Y4-.
El EDTA desprotonado, Y4-, es un agente quelante muy eficaz que forma complejos con la mayoría de metales con la siguiente estructura:
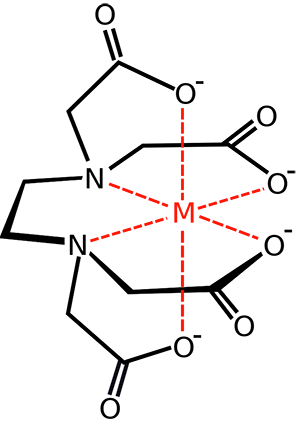
Formación de un quelato entre el EDTA Y4- y un metal
Si el control del pH o la elección correcta del indicador no es suficiente, a veces puede eliminarse la interferencia de un determinado catión añadiendo un agente enmascarante adecuado. Estos reactivos funcionan como ligandos auxiliares al unirse preferentemente con el ion contaminante. Por ejemplo, el ion cianuro puede utilizarse como enmascarante para llevar a cabo la titulación de calcio y magnesio en presencia de otros metales como cadmio, cobalto, cobre, níquel, zinc o paladio.
La dureza del agua se determina de rutina titulando la muestra con EDTA después de ajustar el pH a 10. El magnesio, que forma el complejo de EDTA menos estable de todos los cationes multivalentes que existen en las muestras normales de agua, no se compleja con EDTA hasta que éste se ha añadido en cantidad suficiente para complejar los demás cationes de la muestra.
Determinación de la dureza total del agua
Para determinar la dureza total de un agua, se toman alícuotas (50 o 100 mL) y se acidifican con unas gotas de ácido clorhídrico. Después se tiene que hervir, lo cual hace que se elimine el dióxido de carbono de la muestra. Tras enfriar, se añaden unas gotitas del indicador rojo de metilo (un indicador ácido base) y se neutraliza con hidróxido sódico, NaOH, 0,1M, hasta cambio de color del indicador. Para la determinación tenemos que mantener la muestra a pH 10, por lo que añadimos una solución amortiguadora amoniacal que permita esto. Una vez amortiguada la disolución, se añade el indicador negro de eriocromo T y se titula con una solución patrón de Na2H2Y o con EDTA (H4Y) de concentración 0,01M hasta que se produzca un cambio de color en la disolución, de rojo a azul. Esta determinación nos da la concentración total de calcio y de magnesio y es indistinguible. Si queremos titular con EDTA la muestra solo para la concentración de calcio, se puede llevar a cabo una valoración a pH 13, al cual el magnesio precipita como Mg(OH)2. Se puede consultar un método estandarizado para la determinación de la dureza del agua en el laboratorio en la norma UNE 77040 [2].
Otras formas más sofisticadas de determinar la dureza en el laboratorio consisten, por ejemplo, en el uso de electrodos de membranas líquida específicos para la dureza del agua (determinan simultáneamente calcio y magnesio, aunque existen otros específicos para calcio) o también el uso de HPLC (cromatografía líquida de alta eficacia) con una columna intercambiadora de cationes. Este último método proporciona por separado la concentración de Ca2+ y de Mg2+, pero como hemos visto, con estos dos valores podremos calcular la dureza total.
También te puede interesar:
Gravimetría: fundamento teórico y procedimiento
Más información:
[1] World Health Organization Hardness in Drinking-Water, 2003
[2] Norma UNE 77040:2002 de Calidad del agua. Determinación de la dureza del agua. Método complejométrico con AEDT.
[3] Daniel C. Harris. Análisis químico cuantitativo. Editorial Reverté, 2007.
[4] Colin Baird. Química ambiental. Editorial Reverté, 2004.







[…] http://www.quimitube.com/dureza-del-agua […]
¿Qué es la dureza del agua y cómo se determina en el laboratorio? | Hacia una Cultura Científica, 10 Años Antes
Buenas tardes,
Les agradecería me indiquen cual es el medio mas sencillo de medir la dureza del agua.
Saludos
Mario Fernandez Varela, 8 Años Antes
Hola Mario, la titulación con EDTA es una técnica sencilla, la explicamos en la entrada. Un saludo.
QuimiTube, 8 Años Antes
¿para qué sirve conocer el valor de la dureza de una muestra de agua?
jenny, 5 Años Antes
¡Hola! Pues por ejemplo es importante de cara a saber si es un agua que producirá incrustaciones en las tuberías, los equipos de agua caliente… Cuanto más dura es un agua más detergente necesitas gastar y también se reduce la vida útil de las instalaciones de fontanería, de los electrodomésticos, los termos…
QuimiTube, 5 Años Antes