Contenido del Vídeo
El Tercer Principio de la Termodinámica, propuesto en 1921 por Max Planck, establece que el valor de entropía de un sólido cristalino perfecto es cero en el cero absoluto de temperatura. Es decir, puesto que un sólido cristalino en el cero absoluto es una estructura perfectamente ordenada, su desorden es nulo, es decir, su entropía es nula pues, como hemos indicado en el apartado 16 de teoría de termodinámica: «Espontaneidad de las reacciones químicas. Concepto de entropía«, se puede asimilar la entropía de un sistema a su grado de desorden.
Así, la entropía de un cristal perfecto es nula en el cero absoluto porque al disminuir la temperatura de una sustancia disminuye progresivamente su energía interna, como consecuencia de la disminución de los movimientos moleculares de vibración, rotación y traslación. Si la temperatura sigue disminuyendo, puede llegar un punto (teórico) en el que los movimientos se detengan y el orden sea perfecto. Este punto teórico de mínima temperatura es el cero absoluto, es decir, -273,15ºC, y es un valor no alcanzable experimentalmente (aunque se ha estado cerca en algunos experimentos se trató de condiciones muy particulares). A cero kelvin todas las sustancias son sólidas. Por ejemplo, el hidrógeno, el oxígeno y el nitrógeno tienen los siguientes puntos de fusión:
H2= 14,03 K (≈-239ºC); O2= 50,35 K (≈-223ºC); N2 = 63,14 K (≈-210ºC)
En el cero absoluto, cualquiera de estas sustancias será un sólido, a pesar de sus bajísimos puntos de fusión, ya que todos ellos están por encima de cero grados kelvin. A dicha temperatura mínima, los átomos o moléculas que formen los sólidos no presentarán movimientos, estarán quietos, con desorden nulo y por tanto entropía nula. Ahora bien, no debemos confundir tener entropía cero con tener energía cero: las sustancias en el cero absoluto tendrán su correspondiente energía interna debida a las energías potenciales eléctricas de atracción y repulsión de los núcleos y los electrones, así como a la energía cinética de los electrones, que nunca se detienen (si se detuvieran, el átomo colapsaría).
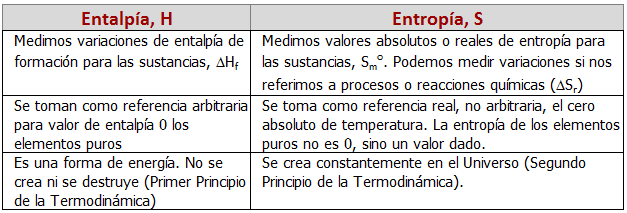
Por tanto, la entropía es cero para un sólido cristalino perfectamente ordenado en el cero absoluto, y va aumentando a medida que aumenta la temperatura y se incrementan con ésta los movimientos moleculares (a mayor temperatura, mayor entropía). Este es el motivo de que todas las sustancias tengan valores de entropía absolutos y positivos, porque tenemos una escala real que empieza en cero y va en aumento. Esto último es, de hecho, una diferencia fundamental con la entalpía o con la energía libre de Gibbs. En el caso de la entalpía, sólo podemos medir incrementos o variaciones, es decir, ΔH, tomando como valor cero una referencia arbitraria, la de los elementos puros, mientras que en la tablas de entropía no hallamos incrementos o variaciones de entropía sino simplemente entropías, S. Como la escala de entropía tiene este cero real, la entropía de los elementos puros no es cero, sino que tiene su correspondiente valor dado. Así, por ejemplo, para el hidrógeno, su variación de entalpía de formación estándar será 0, pero su entropía molar estándar no, sino que tiene un valor de 130,7 J/mol·K. En la tabla siguiente se muestran las principales diferencias existentes entre la entalpía y la entropía:
¿Qué son las entropías molares estándar, Sm0? Son los valores de entropía de cada sustancia en condiciones termodinámicas estándar de 25ºC y 1 atmósfera para 1 mol de sustancia, ya que al ser la entropía una función de estado extensiva, depende de la cantidad de sustancia total, y debemos indicar cuánta sustancia tenemos. Así, las unidades de la entropía molar estándar son J/mol·K.
Para poder determinar cualitativamente qué sustancia tendrá una mayor entropía molar estándar sin recurrir a las tablas, puede ser de utilidad recurrir a algunas consideraciones, que son:
- La entropía de los gases es mayor que la de los líquidos, y la de estos mayor que la de los sólidos.
- En el caso de sustancias con el mismo estado de agregación y similar masa atómica, tendrá mayor entropía la que tenga un mayor número de átomos, por ejemplo, en el caso del etano y del monóxido de nitrógen, ambos con masa molecular 30 g/mol, el etano tiene una mayor entropía molar estándar (229,5 J/K·mol frente a los 210,6 J/K·mol del NO) por tener mayor número de átomos.
- Cuanto más débiles son los enlaces entre los átomos que forman una especie química, mayor es la entropía. Por ejemplo, en el caso del etano, el eteno y el etino (compuestos orgánicos de 2 carbonos con enlace simple, doble y triple respectivamente), el etano es el que tiene una mayor entropía molar porque el enlace simple carbono-carbono es más débil que el enlace doble y este a su vez que el triple.
Los valores de entropía molar estándar son útiles para calcular la variación de entropía de una reacción química, tal y como veremos en el apartado 19 de teoría.
Otros vídeos relacionados:
Termodinámica Teoría 16: Espontaneidad de las reacciones químicas. Concepto de entropía.
Termodinámica Teoría 17: Segundo Principio de la Termodinámica. Entropía del Universo.
Y también:
Todos los vídeos de teoría de termoquímica
Todos los vídeos de ejercicios de termoquímica
Category: Teoría de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Información Bitacoras.com…
Valora en Bitacoras.com: El Tercer Principio de la Termodinámica, propuesto en 1921 por Max Planck, establece que el valor de entropía de un sólido cristalino perfecto es cero en el cero absoluto de temperatura. Es decir, puesto que un sólido cri……
Bitacoras.com, 11 Años Antes
Gracias por tanto material de ayuda. Esta web es un gran aporte!
Tengo algunas dudas:
1) ¿Qué significado tiene un S° negativo (por ejemplo, F- tiene un S°= -13,8 J/molK) si S° = 0 es el estado de máximo orden?
2) ¿Qué otro significado tiene una variación de entropía negativa, además de predecir la no espontaneidad de una reacción? ¿Significa que la reacción requiere de energía «direccionada» para que ocurra?
Gracias por su ayuda!
LTC, 11 Años Antes
¡Hola!
a) Por el tercer principio del la termodinámica sabemos que la entropía de una sustancia no puede ser negativa. Así que imagino que ese dato que das para F- no es su entropía, sino la variación de entropía de alguna reacción en la que se produce fluoruro, por ejemplo quizá sea de F a F-, es decir, la ionización.
b) No siempre una reacción con variación de entropía negativa es no espontánea, dependerá también del valor de la entalpía y de la temperatura a la que se dé la reacción. Si la variación de entropía es negativa significa que hay una disminución del desorden, es decir, que los reactivos son más desordenados que los productos. Puedes ver una predicción del signo de la entropía aquí:
http://www.quimitube.com/videos/termodinamica-ejercicio-32-predecir-el-signo-de-la-variacion-de-entropia-de-algunas-reacciones-quimicas/
QuimiTube, 11 Años Antes
con respecto al tema 18
¿puede una especie quimica quimica tener entropia menor a cero?
ANA LUZ TUPA, 9 Años Antes
¡Hola! No, las entropías molares estándar siempre son positivas. Un saludo.
QuimiTube, 9 Años Antes
Hola, muchas gracias por tus vídeos, me sirvieron para Química de 2º de bachillerato.
Solo un pequeño detalle, en la mini molécula de etano la geometría molecular esta erronea, al tener un enlace sigma, los 6 átomos de hidrógeno deberían de estar lo más alejados posible.
Se te habrá girado.
Saludos y enhorabuena por tener un canal tan bueno y explicar tan bien.
Frank, 9 Años Antes
¡Hola! Muchas gracias 🙂 Ten en cuenta que el enlace simple C-C puede girar, lo que hace que haya distintas conformaciones. La conformación que yo tengo en el modelo molecular en efecto sería la menos probable, pero no errónea, ya que las moléculas con enlaces que pueden girar no son bloques fijos, sino que sus átomos tienen cierto dinamismo. Un saludo grande.
QuimiTube, 8 Años Antes