3 compuestos iónicos insolubles en agua
Escrito por Quimitube el 15 marzo
Cuando en clase se explican por primera vez los tipos de enlaces químicos, y hablamos de las propiedades de los compuestos en base a dichos enlaces, es frecuente indicar que una de las características de los compuestos iónicos es que son solubles en agua. Sin embargo, más adelante, en segundo de bachillerato, vemos los equilibrios de solubilidad en agua y, a pesar de que los compuestos que se tienen en cuenta en este tema son compuestos iónicos, tenemos un rango de solubilidades verdaderamente amplio. No todos los compuestos iónicos son igualmente solubles en agua; de hecho, algunos ni siquiera son solubles.
¿Qué significa que un compuesto iónico sea soluble en agua?
Un sólido iónico es una red muy grande de cationes y aniones dispuestos de forma ordenada; a este orden lo denominamos «estructura cristalina», por lo que todo sólido iónico es un «cristal». Puesto que los cationes son especies con carga positiva, y los aniones especies con carga negativa, lo que mantiene unida la estructura es la atracción electrostática de las carga de signo opuesto.
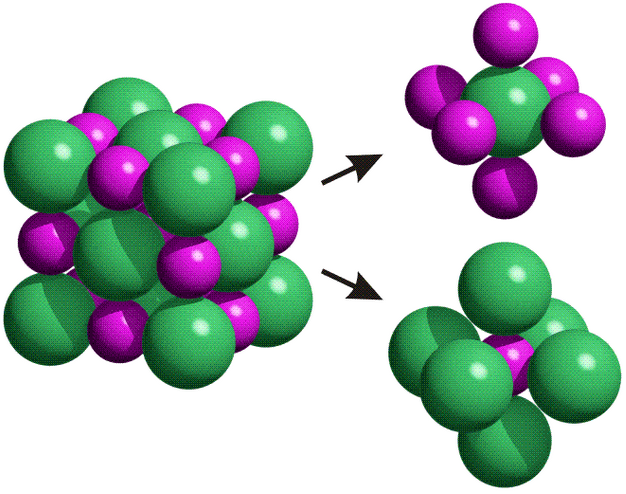
Cuando se forma un mol de compuesto iónico (6,022·1023 pares de iones si la estequiometría es AB), a la energía que se desprende la denominamos energía de red o energía reticular (Ur), según el proceso:
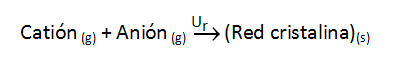
Esta energía se mide en kJ/mol.
Disolver un compuesto iónico implica separar los iones que forman la red (romper la interacción electrostática) al solvatarlos con moléculas de agua, que son dipolos que rodearán a cada ion por el lado del dipolo de carga opuesta al mismo.
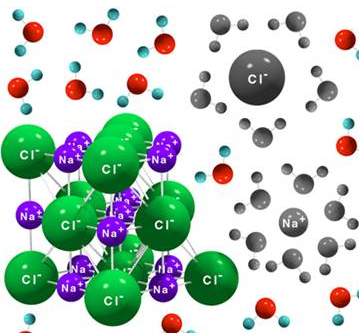
Las moléculas de agua rodean los iones del compuesto iónico y de esta forma se va disolviendo. En la solvatación se desprende cierta cantidad de energía que compensa la disgregación de la red cristalina.
Un compuesto iónico será soluble en agua solo si el proceso global es favorable, es decir, si la solvatación de los iones compensa la energía necesaria para separar los iones del cristal. Cuanto más estable sea el compuesto (mayor sea su energía de red) más difícil será disolverlo.
¿Cómo se mide la solubilidad de un compuesto iónico en agua?
La solubilidad (s) de un compuesto iónico se mide habitualmente en gramos por litro (g/L), es decir, cuántos gramos de dicho compuesto se pueden disolver como máximo en 1 litro de agua, dando lugar a una disolución saturada (lo que significa que si adicionáramos un poco más de sólido a dicha disolución, ya no se disolvería, sino que precipitaría en el fondo del recipiente). También puede expresarse en mol/L.
En función de su solubilidad, las sales se pueden clasificar como:
- Solubles, si s > 0,02 mol/L
- Ligeramente solubles, si s ≅ 0,02 mol/L
- Poco solubles o insolubles, si s < 0,02 mol/L
Como vemos, llamamos insolubles a sales que son muy poco solubles, aunque siempre se disuelven algo en base al siguiente equilibrio de solubilidad:
AnBm(s) ⇔ nAm+ (aq) + mBn- (aq) Equilibrio de solubilidad
Esta solubilidad se puede relacionar también con otro valor utilizado para comparar la solubilidad relativa de distintos sólidos iónicos, el producto de solubilidad, Kps, que es la constante del equilibrio de solubilidad y, por tanto:
Kps = [Am+]n·[Bn-]m Producto de solubilidad
Si deseas profundizar más en el tema de los equilibrios de solubilidad puedes hacerlo aquí.
¿De qué depende la solubilidad de un compuesto iónico?
Como decíamos previamente, un compuesto será más soluble en agua cuanto menor sea su energía de red, porque es más fácil separar los iones mediante solvatación. Así, la solubilidad en realidad depende de aquellos factores de los que a su vez dependa la energía reticular. Los factores que más peso tienen en dicha energía son el tamaño de los iones, la carga de los mismos y el tipo de red cristalina que forma el compuesto. Veamos cómo podemos calcular la energía reticular de un compuesto iónico con la llamada ecuación de Born-Lande:

Si quieres profundizar en el uso de esta ecuación para calcular Ur puedes ver este vídeo.
Algunos compuestos iónicos insolubles en agua
En base a la definición que hemos establecido previamente, podemos decir que un compuesto iónico es prácticamente insoluble si su solubilidad es menor de 0,02 mol/L. Existen ejemplos de sales realmente insolubles, por ejemplo:
Sulfato de bario, BaSO4
Solubilidad: 0,002448 g/L a 20 °C
Kps: 1,08·10-10 (a 25ºC)
Yoduro de plomo (II), PbI2
Solubilidad: 0,756 g/L a 20ºC

Aunque pueda parecer que la solubilidad es alta, hay que tener en cuenta que si la pasamos a molaridad (mol/L) será mucho menor, ya que el yoduro de plomo tiene una masa molar elevada. De hecho, su producto de solubilidad es bastante pequeño, solo 4,41·10-9 a 20ºC.
Cloruro de plata, AgCl
Solubilidad: 0,0051 g/L a 20ºC
Kps: 1,77·10-10 a 25ºC
Pongo estos ejemplos por ser compuestos que se encuentran con asiduidad en un laboratorio o que se utilizan para ilustrar prácticas de solubilidad. Además, el sulfato de bario y el cloruro de plata están implicados en técnicas analíticas que determinan cuantitativamente el bario y la plata precisamente utilizando esta propiedad, su insolubilidad en agua. Sin embargo, hay muchos otros compuestos iónicos altamente insolubles, incluso más que estos, con productos de solubilidad incluso del orden de 10-30 (como el fosfato de calcio, que forma nuestros huesos; afortunadamente no se disuelven en agua) En la tabla que os enlazamos más abajo podéis ver los valores de Kps de una gran cantidad de compuestos. Así que ya sabéis, cuando os digan que «los compuestos iónicos son solubles en agua» es importante matizarlo mucho.
También te puede interesar:
Precipitación del yoduro de plomo en el laboratorio
Tabla de productos de solubilidad a 25ºC de distintos compuestos iónicos





Hola, mucho gusto, soy estudiante de educación media superior en Puebla, México; tengo 16 años y veo muchos de tus videos pues me estoy preparando para la Olimpiada de Química de mi país.
Me has ayudado mucho, te lo agradezco de todo corazón.
Este mensaje es para expresar mis felicitaciones y mi admiración hacia ti.
Desconozco el motivo el motivo por el cual ya no hayas subido videos, aún así, sigo aprendiendo con las decenas de videos que has subido. Me encantaría que hubiese más personas así, tan dedicadas a lo que aman.
Un saludo y abrazo muy fuerte.
Hasta luego, espero que estés bien.
Luis Fernando, 8 Años Antes
Hola Luis Fernando, me alegra mucho que los vídeos te sirvan, mucha suerte con la Olimpiada, es una prueba muy bonita. Ahora mismo estoy dedicándome íntegramente a preparar libros para el acceso a la universidad aquí en España y eso me impide grabar vídeos como me gustaría, pero espero volver a hacerlo pronto. Un abrazo grande y gracias por tu comentario.
QuimiTube, 8 Años Antes