Contenido del Vídeo
En el apartado 16 de teoría de termodinámica hemos introducido el concepto de entropía, indicando que es una función de estado extensiva representada por una S y que mide el grado de desorden microscópico de un sistema. Asimismo, como hemos comentado en dicho apartado, todos los sistemas tienden a un máximo de entropía, y éste es el motivo de que cuando se lleva a cabo una reacción química en un sistema aislado (sin intercambio de materia ni de energía) en el cual el factor energético no puede ser determinante, dado que no se está intercambiando ningún tipo de energía con el entorno, se produzca espontáneamente aquel proceso en el que aumente la entropía del sistema.
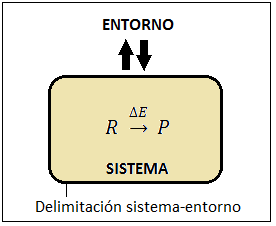
Por tanto, vemos que la entropía del sistema está aumentando, ΔS > 0, a pesar de que no hay ningún tipo de intercambio con el exterior… ¿Cómo es esto posible? Es posible porque la entropía, a diferencia de la energía, sí que se puede crear. De hecho la entropía se crea constantemente en el Universo, no para de aumentar, y esta es la base del Segundo Principio de la Termodinámica. Si nosotros consideramos la totalidad del Universo como un colosal sistema aislado, cualquier proceso espontáneo que tenga lugar en él será aquel que haga que ΔSu > 0 y, por tanto, en efecto, S no para de aumentar y la entropía se va creando.
Así, el Segundo Principio de la Termodinámica se pueden enunciar como:
Considerando el Universo como un sistema aislado, se producirán espontáneamente aquellos procesos en los que la entropía del Universo aumenta, es decir, la entropía del Universo tiende a un máximo.
¿Significa esto que una reacción química siempre tendrá una variación de entropía positiva? No, porque la reacción química no es un sistema aislado. Lo habitual es que se produzca a presión y temperatura constantes, por ejemplo, en un vaso de precipitados en el laboratorio, rodeada de un determinado entorno que es el resto del Universo. Globalmente, la entropía total, ΔSsistema + ΔSentorno, aumentará, ya que:
ΔSsistema + ΔSentorno = ΔSu>0
Por tanto, la entropía del sistema podrá disminuir siempre y cuando la entropía del entorno aumente en una cantidad superior, de modo que el cómputo global haga que aumente la entropía del universo. De hecho, veremos ejemplos de reacciones con ΔS < 0 en algunos de los ejercicios resueltos.
También te puede interesar:
Termodinámica Teoría 16: Espontaneidad de las reacciones químicas. Concepto de entropía.
Termodinámica Teoría 18: Tercer Principio de la Termodinámica. Concepto de entropía molar estándar.
Y también:
Todos los vídeos de teoría de termoquímica
Todos los vídeos de ejercicios de termoquímica
Category: Teoría de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
¿Que ha pasado con este video? Lo he buscado en youtube, vale, pero me parece raro que acá no aparezca.
Por cierto, aprovechando el mensaje, he visto todos tus videos de estructura de la materia, enlace químico y termoquímica y me he quedado fascinado. ¡He aprendido bastante!. Aun cuando ya he llevado química general, quise darle un repaso (puesto que llevare Quimica organica y Fisicoquimica este semestre) y con estos videos he tapado todos esos huecos que en mi curso no había podido comprender. Ahora me siento mas que preparado para este próximo semestre.
Muchísimas gracias por tu labor. Me gustaría seguir viendo mas contenido, se que a todos nos resultara útil 🙂
Jhordan, 11 Años Antes
¡Oh, vaya! Gracias por avisar, no me había dado cuenta… Era un error con el código de inserción de youtube, gracias a tu comentario ya he podido arreglarlo.
Me alegro mucho de que te hayan servido los contenidos y de que gracias a ellos te sientas más preparado, es nuestro objetivo 🙂 Por supuesto seguiremos subiendo más material. Un saludo muy grande y ánimo con tu nuevo semestre.
QuimiTube, 11 Años Antes
Hola. Felicidades por la página.
Estoy leyendo el libro “Las cuatro leyes del Universo”, de Peter Atkins, no se si lo conocerás, y en el capítulo dedicado a la 2.ª Ley (pág. 62) dice:
“… mientras que U es una medida de la cantidad de energía que posee un sistema, S es una medida de la calidad de dicha energía: una entropía alta quiere decir alta calidad; una entropía baja quiere decir baja calidad”.
Esto último es lo que me parece “raro”; entiendo que la “S” es una medida del desorden del sistema, es decir, degradación de la energía y por tanto energía de baja calidad, a más “S” menos calidad.
¿Es como lo señala el libro o es un error?
No entiendo que cuanta más “S” más calidad.
Por otro lado, si calentamos un gas aumentamos su temperatura y también su “S”; parece que a más “S” más calidad.
¿Puedes explicármelo?
Muchas gracias.
Un saludo.
Tomás Pérez, 10 Años Antes
Hola Tomás. A mí también me choca esta afirmación, únicamente se me ocurre que se pueda referir a variaciones de entropía, DS, y no a valores absolutos, pero lo estoy meditando y tampoco me encaja. Desde luego no me atrevo a decirte que en el Atkins pueda haber un error, aunque la entropía es de por sí «energía desperdiciada», una energía que no sirve para su propósito. Sin embargo, si tenemos en cuenta que DG = DG – TDS, un aumento del desorden favorece la termodinámica del proceso. Imagino que la afirmación está hecha en este sentido, alta calidad a nivel de favorecer termodinámicamente la reacción, es decir, cuanto mayor es el aumento de entropía de una reacción más favorecida se verá la misma porque DG se hará más negativa. Es la única idea que se me ocurre con respecto a esto.
Un saludo y muchas gracias por tu interesante pregunta.
QuimiTube, 10 Años Antes
Hola. Ayer escríbí un comentario y se ha borrado, ¿es por algo en particular?
Muchas gracias.
Un saludo.
Tomás Pérez, 10 Años Antes
¡Hola! No, es que no se habría aprobado porque no se aprueban automáticamente, lo siento (no siempre tengo tiempo material para responder al momento). Ya he respondido a tu interesante cuestión. Un saludo grande.
QuimiTube, 10 Años Antes
Hola, Muchísimas gracias por su respuesta. Efectivamente tiene que ser lo que dices porque si no, no se entiende.
La verdad es que el concepto de entropía “S” es complicado y gracias a tus vídeos, tus explicaciones y a Atkins, lo estoy entendiendo.
Para comprenderlo mejor me he imaginado un símil, que te lo expongo para ver qué te parece:
Ganar o perder “S” sería como subir y bajar unas escaleras.
Cada escalón representaría 1º, y la altura del escalón representaría la “S”.
Mientras vamos subiendo cada escalón sería más bajo que el anterior, (se crea menos “S”). Si subo del 5 al 6 se creará más “S” que si subo del 6 al 7; y lo mismo si desciendo, si bajo del 7 al 6 se destruirá más “S” que si bajo del 6 al 5.
Pero si en un sistema solo se varía la temperatura, creará lo mismo que destruirá “S” si sube y baja el mismo tramo; es decir, si asciende su temperatura 5º (sube de 20º a 25º) creará la misma “S” que destruye si desciende esos mismos 5º (de 25º a 20º); pero si dos sistemas suben y bajan, respectivamente, 5º y no están en el mismo “tramo de escalera” uno destruirá menos “S” que creará el otro. Por eso se dice que el flujo de entropía genera entropía.
Me explico: dos sistemas de un mol de agua a 30º y un mol de agua 20º están separados por una pared que transmite calor; al final llegarán a un equilibrio térmico, pero el primero “baja” 5º (tramo de 30º a 25º) y el otro “sube” 5º (tramo de 20º a 25º), el segundo genera más “S” que pierde el primero, por lo que la variación de “S” es positiva, (flujo de “S” crea “S”); pero los dos sistema al final tendrán la misma “S” (porque la entropía es una función de estado extensiva).
Esto ocurre también cuando tienes un mol de agua a 30º y lo juntas con otro mol a 20º, obtienes un equilibrio a 25º, el sistema a ganado “S”.
Pero la duda que yo tenía era que si el sistema ha ganado “S”, (uno pierde pero el otro gana más) ¿cómo es posible que tenga al final la misma “S” que en el ejemplo anterior?
Y la respuesta, creo, es porque tiene más masa (propiedad extensiva) justamente el doble que el principio (dos moles), pero si coges solo 1 mol, obligatoriamente tendrá la misma “S” que en el ejemplo anterior.
Conclusión; lo importante es fijarse en el tramo de escalera que sube o baja para saber si crea más o menos “S”; pero subamos o bajemos cualquier tramo, si al final estamos en el mismo “escalón” la entropía será la misma, pues estamos a la misma temperatura.
Un saludo y perdona por la extensión.
Una duda:
En tu respuesta anterior me dices DG = DG – TDS ¿no será DG = DH – TDS?
Felicidades por tu trabajo. Muchas gracias.
Tomás Pérez, 10 Años Antes
Hola de nuevo, Tomás. Un símil impresionante… no te preocupes por la extensión, al contrario, ha sido una lectura muy interesante. Estás profundizando muchísimo en el concepto de entropía, es fenomenal.
Efectivamente me he equivocado con la fórmula, es DG = DH – TDS.
Un saludo grande
Quimitube, 10 Años Antes
Gracias por todo.
Hasta otra ocasión.
Un saludo.
Tomás Pérez, 10 Años Antes
Hola. Al releer el comentario anterior me he dado cuenta de que cometí un error; lo rectifico.
Donde dice:
y lo mismo si desciende, si bajo del 7 al 6 se destruirá más “S” que si bajo del 6 al 5.
Debe decir:
y lo mismo si desciende, si bajo del 7 al 6 se destruirá MENOS “S” que si bajo del 6 al 5.
Es lógico, pues se tiene que destruir lo mismo que se crea (para el mismo tramo) y si de 6 a 7 se crea menos, de 7 a 6 se destruirá menos.
Un saludo.
Tomás Pérez, 10 Años Antes
estan muy buenos los videor como pudo suscribirme con ustedes
Juan Carlos, 9 Años Antes
Hola Juan Carlos, muchas gracias, no tenemos suscripción a la página pero si quieres saber de más vídeos puedes suscribirte a nuestro canal de youtube. Un saludo grande.
QuimiTube, 9 Años Antes