Contenido del Vídeo
Cuando se trabajo con equilibrios en los que todas las especies que intervienen son gases, es habitual utilizar la denominada constante de equilibrio Kp, en función de las presiones parciales, en lugar de Kc, en función de las concentraciones. Así, para la siguiente reacción genérica:
aA + bB ⇔ cC + dD
La constante de equilibrio Kp tiene la siguiente expresión:
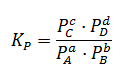
Donde Px es la presión parcial de cada uno de los componentes una vez alcanzado el equilibrio. Dichas presiones vienen expresadas en atmósferas. Como Kc, la constante de equilibrio Kp depende únicamente de la temperatura y es adimensional, no indicamos unidades.
Supongamos que para el siguiente equilibrio tenemos los siguientes datos de presiones parciales en el equilibrio:
N2(g) + O2(g) ⇔ 2NO(g)
PN2 = 178,8 atm; PO2 = 88,5 atm; PNO = 3,6atm
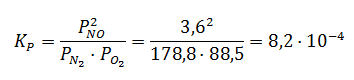
Aunque es frecuente expresar la constante de equilibrio entre gases como Kp, también se puede expresar como Kc y, de hecho, existe una relación entre ambas constantes, de forma que conociendo Kp se puede calcular Kc y viceversa. Vamos a deducirla.
Para relacionar ambas constantes, partiremos de la ecuación de los gases ideales:
P·V = n·R·T
Donde:
P: presión en atmósferas
V: volumen en litros
n: número de moles
R: constante de los gases ideales, 0,082 atm·L/K·mol
T: temperatura, en K
Despejando la presión:
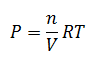
Sustituyendo la presión en la expresión de Kp para cada componente:
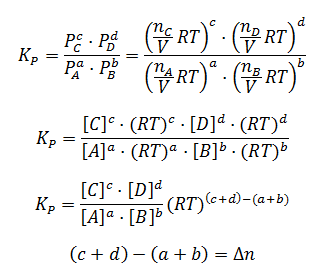
Finalmente, llegamos a la siguiente expresión
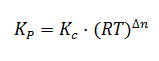
Category: Equilibrio Químico, Teoría de Equilibrio Químico y Vídeos Equilibrio Químico.
Etiquetas: Constante de equilibrio.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Buenas, el ultimo resultado me da, por mas vueltas que le de, distinto al tuyo, es un calculo sencillo por lo que creo que puedes tener algún error.
Juan, 10 Años Antes
Hola Juan, efectivamente hay un error, si te fijas en el minuto 9:14 aparece una anotación en la que indicamos el problema, que es Kc lo que vale 0,0141 y Kp lo que calculamos y no al revés. Un saludo y gracias por tu comentario.
QuimiTube, 10 Años Antes
Hola, muy buen video, te entendí a ti en unos cuantos minutos a lo que no le entendí a mi profe en 30 minutos. Gracias
Juan Carlos, 9 Años Antes
¿La presión afecta a Kp, o sólamente afecta a que se desplace el equilibrio hacia los productos o reactivos?
Lorena Villegas, 9 Años Antes
¡Hola! Afecta a Kp, precisamente por esto el sistema debe evolucionar, para volver a alcanzar las concentraciones que ahora hacen que se cumpla la nueva Kp. Siempre que alteramos el equilibrio estamos alterando la constante y por esto hay un cambio. Un saludo grande.
QuimiTube, 9 Años Antes
querelacion existe entre la constante de equilibrio y la composicion
reinier gonzalez, 8 Años Antes
¡Hola! No entiendo muy bien la pregunta…
QuimiTube, 8 Años Antes
hola es larelacion que existe entre kp y la fraccion (Y) de vapor como se realcionan ya que la constnte kp tambioen puede estar en funcion a las fraccion molar (X)
reinier gonzalez, 8 Años Antes
Hola, tengo un problema donde solo me dan los moles de reactivo y kp. Me piden que calcule la presion parcial de cada especie en equilibrio, me podrian ayudan?
nicole, 8 Años Antes
Hola Nicole, imagino que será un gas que se disocia, de modo que debes plantear los moles que tendrás en el equilibrio en función del grado de disociación, alfa. Así alfa será tu única incógnita y podrás despejarlo porque conoces Kp. Luego con los moles de cada gas podrás calcular la presión parcial de cada uno de ellos con la ecuación de los gases ideales, P·V = n·R·T. Mira este ejercicio, será similar:
http://www.quimitube.com/videos/calcular-alfa-a-partir-de-kp
QuimiTube, 8 Años Antes
Hola, estoy bastante liada con un ejercicio donde me piden Kc, alfa y presiones parciales. Dejo el enunciado:
» 0’1 mol de N2O4(g) se descompone a 45ºC, 1L de recipiente para dar NO2(g). Cuando se alcanza el equilibrio, la presión total es de 3,18 atm.»
No aporta ningún otro dato y me lío porque no sé cómo hallar el grado de disociación y Kc a la vez… Tu respuesta me serviría de mucha ayuda!!
Carolina, 8 Años Antes
Hola Carolina, ¿lo has planteado? ¿Me puedes decir en qué punto concreto tienes dudas? Te sugiero que veas otros vídeos de equilibrio y lo intentes plantear hasta donde consigas llegar… yo no puedo resolverlo ni es el objetivo de la página, sino que aprendáis por vosotros mismos. Aquí tienes todos los ejercicios de equilibrio:
http://www.quimitube.com/ejercicios-equilibrio-quimico
Como orientación: Ten en cuenta que de los 0,1 moles iniciales de N2O4 se descompondrán x y aparecerán 2x de NO2 (porque la reacción será N2O4 <--> 2NO2. Puedes calcular el número de moles totales en el equilibrio (0,1-x + 2x) y de ahí calcularlos con la ley de los gases ideales P·V = nRT…
¡Mucha suerte!
QuimiTube, 8 Años Antes
Buenas tardes. Saludos Desde Perú. Disculpen quisiera saber si [a] es la concentración, pero es concentración de hidrógeno ? o que concentración. recién estoy iniciando en el tema y haremos la otra semana en mi centro de estudios y estoy indagando. respondame por favor si.
Junior Paolo Mas Aguilar, 8 Años Antes
¡Hola! Siempre que veas los corchetes en química [] hacen referencia a una concentración molar (moles/litro). Por tanto, si tienes [A] es la concentración de una especie genérica A, después lo tendrás que aplicar a tu reacción concreta. Ánimo con tus estudios, un saludo.
QuimiTube, 8 Años Antes
Hola, tengo una duda y es que la fórmula de Kp=Kc(RT)^incremento n ¿El incremento de n no debería ser negativo? Es decir, la misma fórmula pero elevado a -incremento de n … Es que he visto las dos formulas y no sé cuál es la correcta. Gracias por tus vídeos, me encanta como explicas 🙂
Maria, 8 Años Antes
¡Hola Maria! En la fórmula tal y como está escrita es positivo, aunque el valor en sí puede ser negativo en una reacción en la que haya menos moles de gas de productos que de reactivos. No obstante, tal vez la hayas visto con el exponente negativo si lo que tienes despejado es Kc, es decir, Kc = Kp(RT)^(-Dn). Un saludo y gracias por tu comentario.
QuimiTube, 8 Años Antes
hola una pregunta en esta formula Kc = Kp(RT)^(-Dn) que es ^(-Dn)??? gracias por los materiales que brindas en tu sitio .
Nancy, 5 Años Antes
¡Hola! Es la variación del número de moles gaseosos entre reactivos y productos. Si por ejemplo tienes una reacción en la que todos son gases y su estequiometría es 2A + 3B –> 7C, Dn es = 7 (moles de los productos, en este caso solo C) – 5 (2 moles de A y 3 de B, que los sumamos) = 2.
QuimiTube, 4 Años Antes
Hola buenas! Tengo una duda, de esa fórmula, como podría despejar T? Quiero decir me piden en un ejercicio una T en la que el valor de Kp y Kc sean iguales, e intuyo que a partir de esta formula se puede sacar, pero más que lo intento no consigo despejar bien la T.
Muchas gracias, tus videos me han salvado en mas de una ocasión <3
Marta, 4 Años Antes
¡Hola Marta! Me alegra que te hayan servido. ¿Tienes la reacción concreta? ¿O te lo preguntan de forma genérica? Si consideras que ambas constantes son iguales, entonces puedes pasar Kc dividiendo a Kp y, al ser iguales, el cociente será 1. Así, te queda:
1 = (RT)^(Dn)
Aunque realmente no importa lo que valga el incremento del número de moles, dado que para despejar RT lo que tendrás que hacer es la raíz enésima de 1:
Raíz enésima (1) = RT
Y la raíz enésima de 1 siempre es 1.
Por tanto, basta que busques aquel valor de T para el cual el cociente con R te dé 1.
Espero haberte ayudado.
Un saludo.
QuimiTube, 4 Años Antes