¿El aluminio se oxida?
Escrito por Quimitube el 20 diciembre
Los distintos metales y su corrosión
En una entrada anterior hablamos de la oxidación del hierro, un metal que tiene mucha tendencia a corroerse a la intemperie. La resistencia a la corrosión de los metales y sus aleaciones es, de hecho, un campo muy importante de estudio en química; es lógico, si tenemos en cuenta la gran cantidad de estructuras que están fabricadas con metales y las consecuencias económicas que conlleva su corrosión. Es necesario protegerlos de dicho proceso con recubrimientos eficaces (lo cual mueve muchísimos millones de euros en la industria de la pintura) o bien sustituir periódicamente el material que se ha degradado. Probablemente es el hierro el metal cuyo óxido más visualizamos: esa capa rojiza y pulverulenta que se adhiere a nuestros dedos cuando la tocamos, como esta:
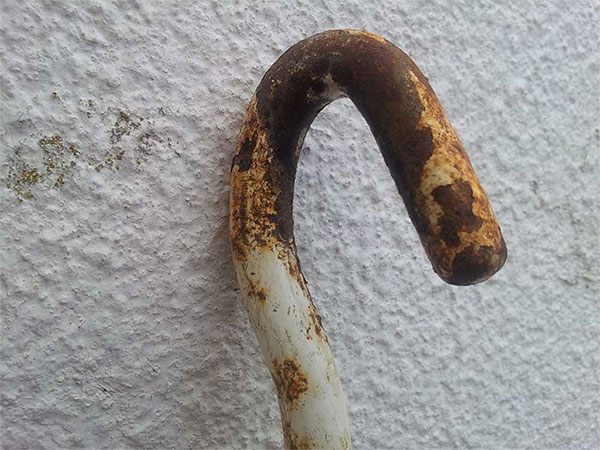
La capa rojiza que recubre muchos elementos de hierro que están a la intemperie es óxido de hierro, Fe2O3
Sin embargo, no es el hierro el único metal que se oxida en determinadas condiciones. Le ocurre a otros metales, como al cromo, al cobre (que se recubre de una pátina verde) o al aluminio.

El cobre y sus aleaciones también se oxidan, formando una capa de color verdoso
¿Se puede oxidar el aluminio?
Tal vez os llame la atención que haya mencionado al aluminio en el anterior párrafo. ¿Es que acaso el aluminio se oxida? Pues la respuesta es sí y, de hecho, es mucho más susceptible a la presencia de oxígeno atmosférico que el hierro, siendo su reacción muchísimo más veloz. Cualquier estructura de aluminio o el papel de aluminio que tenemos habitualmente en casa están oxidados en su superficie, lo que ocurre es que dicha capa de óxido no tiene un color distinto, como sí ocurre en el hierro y en el cobre. Y no solo es indistinguible y no permite que nos demos cuenta a simple vista de la oxidación, sino que además actúa como una capa protectora del resto del metal, haciendo que la corrosión no se extienda al núcleo del mismo.
El aluminio es un metal altamente reductor. Basta ver el potencial estándar de la siguiente semirreacción:
Al3+ + 3e → Alo Eo = -1,67 V
Este potencial estándar negativo para dicha reacción nos indica que la semirreacción que realmente es termodinámicamente más favorable es la reacción contraria, es decir, la oxidación del aluminio para formar el catión Al3+. Depende, claro está, del elemento al cual se enfrente, pero en el caso del oxígeno atmosférico la reacción redox de formación de óxido de aluminio, Al2O3, ocurre efectivamente, del siguiente modo:
Semirreacción de oxidación:
Alo → Al3+ + 3e
Semirreacción de reducción:
O2 + 4e → 2O2-
Reacción global
4Alo + 3O2 → 2Al2O3(s)
Esta capa formada de un modo natural tiene un grosor aproximado de entre 20 y 100Å, es decir, entre 0,000002 y 0,00001 milímetros. Como vemos, se trata de una capa muy fina y, además, no es inmune a todas las condiciones, a pesar de que, como hemos comentado, el óxido de aluminio formado protege el resto del metal. La capa de alúmina puede ser fácilmente atacada por ácidos y bases fuertes, como el ácido clorhídrico, el ácido sulfúrico o el hidróxido sódico. Esto se debe a que el óxido de aluminio tiene un comportamiento anfótero, es decir, se comporta como un ácido frente a las bases y como una base frente a los ácidos. Así, en medio ácido, tenemos:
Al2O3 (s) + 6H+ (ac) → 2Al3+ (ac) + 3H2O (l)
Y en medio básico:
Al2O3 (s) + 2OH– (ac) + 3H2O (l) → 2[Al(OH)4]– (ac)
Aunque, si las condiciones no son muy agresivas y se eliminan del entorno del metal, la capa de alúmina no tarda en regenerarse nuevamente por la presencia del oxígeno atmosférico, protegiéndolo de nuevo contra la corrosión procedente del exterior. A la formación de esta capa en la superficie del aluminio se le denomina pasivado del mismo, y se puede inducir por diversos métodos industriales para lograr que el grosor sea mucho mayor que la capa producida de forma natural y que, por tanto, la protección aumente. Seguramente os sonará también el término aluminio anodizado, que es de uso bastante común.
El aluminio anodizado permite, además de proteger mejor el aluminio, recubrirlo con una capa coloreada que se puede utilizar con fines decorativos
Dicho anodizado se lleva a cabo mediante un proceso electroquímico en medio ácido sulfúrico para aumentar el grosor del Al2O3 de la superficie. Así, el aluminio obtenido tiene excelentes propiedades de resistencia a los agentes químicos, dureza y baja conductividad eléctrica. Además no es afectado por la luz solar y tampoco se pela, ya que la capa de óxido forma parte de la propia estructura. En general, cualquier factor que mejor la integridad y la adherencia de esta capa hará que mejore la resistencia a la corrosión.






[…] En una entrada anterior hablamos de la oxidación del hierro, un metal que tiene mucha tendencia a corroerse a la intemperie. La resistencia a la corrosión de los metales y sus aleaciones es, de hecho, un campo muy importante de estudio en química; es lógico, si tenemos en cuenta la gran cantidad de estructuras que están fabricadas con metales y las consecuencias económicas que conlleva su corrosión. […]
¿El aluminio se oxida? | Artículo..., 9 Años Antes
[…] En una entrada anterior hablamos de la oxidación del hierro, un metal que tiene mucha tendencia a corroerse a la intemperie. La resistencia a la corrosión de los metales y sus aleaciones es, de hecho, un campo muy importante de estudio en química; es lógico, si tenemos en cuenta la gran cantidad de estructuras que están fabricadas con metales y las consecuencias económicas que conlleva su corrosión. […]
¿El aluminio se oxida? | tecno4 | Scoop..., 9 Años Antes
muy buenísimos los contenidos, no si se tiene una explicación sobre los enlaces del ion superoxo o hiperoxido
Walter Blanco, 9 Años Antes
Hola Walter, gracias por tu comentario. Lo lamento, no tengo la información que indicas, es muy específica. Un saludo grande.
QuimiTube, 9 Años Antes
[…] El aluminio reacciona rápidamente con el oxígeno atmosférico para formar alúmina, Al2O3, un óxido que no se puede distinguir a simple vista. […]
¿El aluminio se oxida? | Quimitube | El ..., 9 Años Antes
Hola! Quisiera saber si poner un cenicero de pie de aluminiio a la intemperie lo perjudica. Gracias!
Debora, 8 Años Antes
Cómo ves en la entrada se oxidará, aunque probablemente no se notará en su apariencia. Dependiendo de las condiciones climáticas la oxidación puede ser mayor y llegar a dañarlo pero es más improbable que si fuese de otros metales como hierro.
QuimiTube, 8 Años Antes
Buenas tardes, estoy pensando en cambiar unas balizas del jardín de mi casa , había pensado en ponerlas de aluminio, pero lo que no quiero es que dentro de un corto periodo de tiempo tenerlo que cambiar porque está feo. También comentarte que está el regadío y es en zona costera. Las que estaban no se de que material serán pero están super feas y deterioradas. He leído que se oxida pero que no se aprecia. Me podrías aconsejar por favor?
Muchas Gracias
Tania, 8 Años Antes
Hola Tania, en efecto la oxidación del aluminio es menos apreciable que la de otros metales, sin duda, pero no sé hasta qué punto no se pondrá feo a la intemperie y en zona costera (donde se deteriora mucho más). Depende también de la calidad del aluminio en sí, de la humedad… Por eso no me veo capaz de recomendarte, lo cierto es que no tengo experiencia personal ni de laboratorio en este tema y no sé decirte… Un saludo grande.
QuimiTube, 8 Años Antes
Mi pregunta es la siguiente; el aluminio es aplicado en la industria alimenicia como en las latas de Gaseosa.
en el caso de los aerosoles que usan sus valvulas de Aluminio.
Mi pregunta es la siguiente:
Si fabrico un en envase de acero Inox. (barril) para cerveva y para extraer el liquido uso una valvula como la de los aerosoles.
El hecho de estar realizada la Valvula con aluminio, y tiene oxidacion.
Puede se nocivo para lo que quiero hacer o el hecho de estar ensamblada esta valvula sobre un asiento de inoxidable puede usarse
Daniel Fernandez, 8 Años Antes
Hola Daniel, yo diría que puedes usarla pero no tengo conocimientos en esta materia, de modo que es preferible que busques bibliografía en profundidad sobre ingeniería alimentaria. Un saludo grande.
QuimiTube, 8 Años Antes